|
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Кислоты, их классификация и свойства При обычных условиях кислоты могут быть твердыми (фосфорная Н3Р04, кремниевая Н2SiO2) и жидкими (в чистом виде жидкостью будет серная кислота H2SO4).
Такие газы, как хлороводород HCl, бромоводород НВг, сероводород H2S, в водных растворах образуют соответствующие кислоты.
Вы уже знаете, что угольная Н2СО3 и сернистая H2SO3, кислоты существуют только в водных растворах, так как являются слабыми и нестойкими. Они легко разлагаются на оксиды углерода (IV) и серы (IV) — С02 и SO2, соответственно, и воду. Поэтому выделить эти кислоты в чистом виде невозможно.
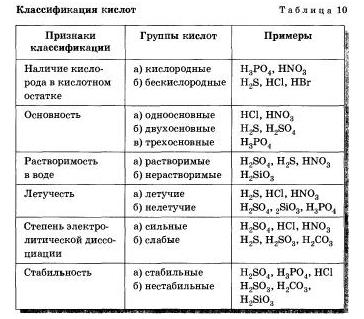
Разделение кислот на группы по различным признакам представлено в таблице 10.
Часто путают понятия летучесть и устойчивость (стабильность). Летучими называют кислоты, молекулы которых легко переходят в газообразное состояние, то есть испаряются. Например, соляная кислота является летучей, во устойчивой, стабильной кислотой. О летучести нестабильных кислот судить нельзя. Например, нелетучая нерастворимая кремниевая кислота при стоянии разлагается на воду u SiO2.
Водные растворы соляной, азотной, серной, фосфорной и ряда других кислот не имеют окраски. Водные растворы хромовой кислоты Н2СгJ2 имеют желтую окраску, марганцевой кислоты НМnО4 — малиновую.
Однако, какими бы разными ни были кислоты, все они образуют при диссоциации катионы водорода, которые и обусловливают ряд общих свойств: кислый вкус, изменение окраски индикаторов (лакмуса и метилового оранжевого), взаимодействие с другими веществами.
Типичные реакции кислот

Аналогично протекает эта реакция и с нерастворимыми основаниями:
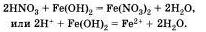
Вторая реакция протекает между оксидами металлов и большинством кислот, например:
CuO+ H2SO4 = CuSO4+ H2O
Чтобы прошли третья реакция, необходимо выполнить несколько условий.
1) Ознакомимся с рядом напряжений металлов (точнее, рядом стандартных электронных потенциалов):
К, Са, Na, Мn, Аl, Zn, Fе, Ni, Sn, РЬ, Н2, Сu, Нg, Аg, Аu. Металл должен находиться в этом ряду до водорода.
А вот реакция между раствором соляной кислоты и медью невозможна, так как медь стоит в ряду напряжений после водорода.
2) Должна получиться растворимая соль. Во многих случаях взаимодействие металла с кислотой практически не происходит потому, что образующаяся соль нерастворима и покрывает поверхность металла зашитной пленкой, например:
Рb + H2SO4 =/ PbSO4 + H2
Нерастворимый сульфат свинца (II) прекращает доступ кислоты к металлу, и реакция прекращается, едва успев начаться. По данной причине большинство тяжелых металлов практически не взаимодействует с фосфорной, угольной и сероводородной кислотами.
3) Третья реакция характерна для растворов кислот, поэтому-нерастворимые кислоты, например кремниевая, не вступают в реакции с металлами.
4) Концентрированный раствор серной кислоты и раствор азотной кислоты любой концентрации взаимодействуют с металлами несколько иначе, поэтому уравнения реакций между металлами и этими кислотами записываются подругой схеме. Разбавленный раствор серной кислоты взаимодействует с металлами. стоящими в ряду напряжении до водорода, образуя соль и водород.
Четвертая реакция является типичной реакцией ионного обмена п протекает только в том случае, если образуется осадок или газ, например:
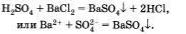
Приведем пример реакции кислоты с солью, протекающей с выделением газа:
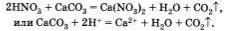
1. Классификация кислот.
2. Типичные свойства кислот: взаимодействие их с металлами, оксидами металлов, гидроксидамн металлов и солями.
3. Условия протекания типичных реакций кислот
4. Ряд напряжений металлов.
Какая кислота является сильной: а) Н2S; б) НNO3; в) Н2SiО3?
Дайте характеристику азотистой кислоты, используя различные признаки классификации кислот.

Если реакция не может быть осуществлена, объясните почему.
Какой объем водорода (н. у.) выделится при растворении в соляной кислоте 120 г магния, содержащего 25% примесей?
Запишите формулы оксидов, которые будут соответетвовать следующим кислотам: HN02, HNO3, Н3Р04, Н2SO3, H2SO2, H2SiO3.
сборник конспектов уроков по химии, курсы учителю химии 8 класса, видеоклипы к урокам
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|