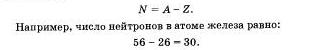|
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Основные сведения о строении атомов
Вы уже знаете, что любой химический элемент, как правило, может существовать в трех формах: свободные атомы, простые вещества и сложные вещества. Рассмотрим порвую форму — свободные атомы.
Понятие атом возникло еще в античном мире для обозначения частиц вещества. В переводе с греческого атом означает "неделимый".
Ирландский физик Стони на основании опытов пришел к выводу, что электричество переносится мельчайшими частицами, существующими в атомах всех химических элементов. В 1881 г. Стони предложил эти частицы назвать электронами, что означает по-гречески «янтарь».
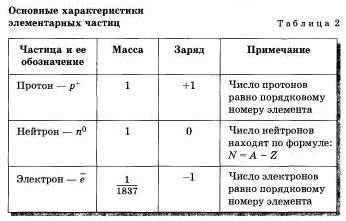
Через несколько лет после того, как электрон получил свое название, английский физик Джозеф Томсон и французский физик Жан Перрен доказали, что электроны несут на себе отрицательный заряд. Это наименьший отрицательный ларнд, который в химии принят за единицу (-1), а Томсон даже сумел определить скорость движения электрона (она равна скорости света — 300 ООО км/с) и массу электрона (она почти в 2000 раз меньше массы атома водорода).
Томсов и Перрен соединили полюса источника тока с двумя металлическим и пластинами — катодом и анодом, впаянными в стеклянную трубку, из которой был откачан воздух. При подаче на пластины-электроды напряжения около 10 тысяч вольт в трубке вспыхивал светящийся разряд, а от катода (отрицательного полюса) к яподу (положительному полюсу) летели частицы, которые ученые сначала назвали катодными лучами, а затем выяснили, что это был поток электронов. Электроны, ударяясь об особые вещества, нанесенные, например, на экран телевизора, вызывают свечение.
Был сделан вывод — электроны вырываются иа атомов материала, из которого сделан катод.
Свободные электроны или поток их можно получить и другими способами, например при накаливании металлической проволоки или при падении света на металлы, образованные элементами главной подгруппы 1 группы таблицы Менделеева, например цезий.
Но не только электроны входит в состав атомов.
Физик Анри Неккерель обнаружил, что природный минерал, содержащий соль урана, тоже испускает неведомое излучение, засвечивая фотопластинки, закрытые от света. Это явление было названо радиоактивностью.
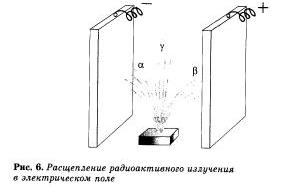
Различают три вида радиоактивных лучей:
ã-лучи, которые состоят ил а-частиц. имеющих заряд в 2 раза больше за рядя электрона, во с положительным знаком, и массу в 4 разя больше массы атома водорода.
ß-лучи представляют собой поток электронов;
Ŷ-лучи — это электромагнитные волвы с ничтожно малой массой и не несущие электрического заряда.
Следовательно, атом имеет сложное строение — состоит на положительно заряженного ядра и электронов.
Как же устроен атом?
В 1910 г. в Кембридже, близ Лондона, Эрнест Резерфорд со своими учениками и коллегами изучал рассеивание ã-частиц, проходящих через тоненькую золотую фольгу и падавших на экран. Альфа-частицы обычно чуть отклонялись от первона-чального направления, всего на один градус, подтверждая, казалось бы, рав номери ость и однородность свойств атомов золота. И вдруг — о чудо! — исследователи заметили, что некоторые ã-частицы резко меняли направление своего пути, будто наталкивались на какую-то преграду.
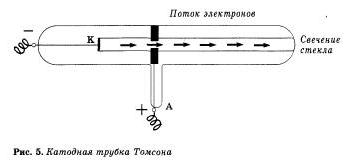
Разместив экран перед фольгой, Резерфорд сумел обнаружить даже те редчайшие случаи, когда «-частицы, отразившись от атомов золота, летели прямо в противоположных направлениях.
Расчеты показали, что наблюдаемые ими явления могли произойти, если бы вся масса атома н весь его положительный заряд были сосредоточены в крохотном центральном ядре. Радиус ядра, как выяснилось, в 100 000 раз меньше радиуса всего атома, той его области, в которой находятся электроны, имеющие отрицательный заряд. Если применить образное сравнение, то весь объем атома можно уподобить стадиону в Лужниках, а ядро — футбольному мячу, положенному в центр поля.
Атом любого химического элемента — как бы крохотная Солнечная система. Поэтому такую модель атома, предложенную Реэерфордом. называют яллнетарной.
Но и это не все. Оказывается, н крошечное атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов — протонов и нейтронов.
Протоны имеют заряд, равный заряду электронов, но противоположный по знаку (+1). и массу, равную массе атома водорода (она принята в химии за единицу). Обозначаются протоны знаком 1 1 р(р+). Нейтроны не несут заряда, они нейтральны и имеют массу, равную массе протона, то есть I. Обозначают нейтроны знаком 1 0 n (или nº).
Сумма числа протонов и нейтронов в атоме называется массовым числом. Например, массовое число атома алюминия:
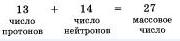
Так как массой электрона, ничтожно малой, можно пренебречь, то очевидно, что в ядре сосредоточена вся масса атома. Электроны обозначают ê.
Поскольку атом электронейтрален, то также очевидно, что число протонов и электронов в атоме одинаково. Оно равно порядковому номеру химического элемента, присвоенному ему в Периодичоской системе. Например, в ядре атома железа содержится 26 протонов, а вокруг ядра вращается 26 электронов.
А как определить число нейтронов?
Как вам уже известно, масса атома складывается из массы протонов и нейтронов. Зная порядковый номер элемента (Z), то есть число протонов, и массовое число (А), равное сумме чисел протонов и нейтронов, можно найти число нейтронов (N) по формуле:
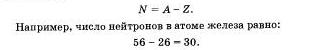
1. Атом — сложная нейтральная частица, состоящая из протоков, электронов и нейтронов.
2. Некоторые характеристики этик частиц приведены в таблице 2.
3. Вся масса атома сосредоточена в его ядре, объем которого чрешычайно мал по сравнению с объемом атома.
4. Атом — электро нейтрален, так как содержит одинаковое число протонов и электронов, равное порядковому номеру химического элемента.
Какие научные открытия доказали, что атом сложная частичка, что он делим?
Объясните слова Л. М Бутлерова, который задолго до открытия Беккереля писал: «Атомы не неделимы по своей природе, а неделимы только доступными нам ныне средствами...
Определите число протонов, электронов и нейтронов для атомов элементов: магния, фосфора, золота.
Пользуясь этимологическим словарем, объясните, почему планетарную модель строения атома. предложенную зерфордом. называют также нуклеарной. Почему протоны и нейтроны вместе называют нуклонами?
Порядковый номер химического элемента равен 35. Какой это элемент? Чему равен заряд ядра его атома? Сколько протонов, электронов и нейтронов содержит его атом?
информация для школьников 8 класса, задания для использования учителями химии, шпаргалки по всем предметам
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|