|
Реферат до уроку з предмету Хімія 9 клас
Тема: Білки: склад і будова. Гідроліз, денатурація
Надіслано Клуннік Л.А.,вчителем Міжнародного ліцею "Гранд"
Белки в природе
Белки представляют наиболее важную составную часть организмов. Они содержаться в протоплазме и ядре всех растительных и животных клеток и являются главными носителями жизни. Там, где нет белковых веществ, нет жизни. По определению Ф. Энгельса, « жизнь есть способ существования белковых тел ».
Молекулярная масса белков выражается десятками и сотнями тысяч, а у некоторых белков достигает нескольких миллионов.
Функции белков в организме многообразны. Белки служат тем пластическим материалом, из которого построены опорные, мышечные и покровные ткани. С помощью белков осуществляется перенос веществ в организме, например доставка кислорода из лёгких в ткани и выведение образовавшегося оксида углерода (IV).
Белки-ферменты катализируют в организме многочисленные химические реакции. Гормоны (среди них есть вещества белковой природы) обеспечивают согласованную работу органов. В виде антител, вырабатываемых организмом, белки служат защитой от инфекции.
Различных белковых веществ в организме тысячи, и каждый белок выполняет строго определённую функцию. Для любой химической реакции, протекающей в организме, существует свой отдельный белок-катализатор (фермент).
От чего зависит такое многообразие функций белков и их особая роль в жизненных процессах?
Состав и строение белков.
Основные сведения о составе и строении белков получены при изучении их гидролиза. Установлено, что в результате гидролиза любого белка получается смесь -аминокислот, причём наиболее часто встречаются в составе белков двадцать аминокислот.
Строение некоторых-аминокислот, образующих белки, представлено в таблице:
Легко заметить, что строение аминокислот, составляющих белки, можно выразить общей структурной формулой:
NH
В составе радикала могут быть открытые цепи, циклы и различные функциональные группы. Молекулы приведенных выше аминокислот, как видим, содержат в радикале группы атомов: -SH, - OH, -COOH, -NH2 и даже бензольное кольцо.
Как же аминокислоты образуют белковую молекулу?
Ещё в 80-х годах прошлого столетия русский биохимик А.Я. Данилевский указал на наличие пептидных групп в белковой молекуле. В начале ХХ в. немецкий ученый Э. Фишер выдвинул полипептидную теорию, согласно которой молекулы белка представляют собой длинные цепи остатков аминокислот, соединённых пептидными (амидными) связями.
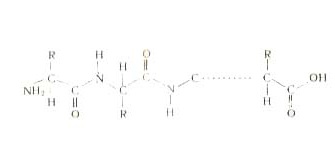
Упрощённо синтез полипептида можно представить следующим образом:
Полипептидная теория строения белка в настоящее время считается общепризнанной. Так как природные белки являются высокомолекулярными соединениями, в их полипептидных цепочках аминокислотные остатки повторяются многократно. при этом каждый индивидуальный белок имеет свою строгую последовательность аминокислотных звеньев.
Подобно тому как из определённого числа букв алфавита Составляются разнообразные слова, так из набора двадцати аминокислот может быть образовано практически безграничное количество белков.

Последовательность чередования различных аминокислотных звеньев в полипептидной цепи называется первичной структурой белковой молекулы .
Пространственная конфигурация, которую принимает полипептидная цепь, называется вторичной структурой белка (рис.2).Такая структура удерживается благодаря многочисленным водородным связям между группами -СО¬- и –NH-, расположенными на соседних витках спирали.
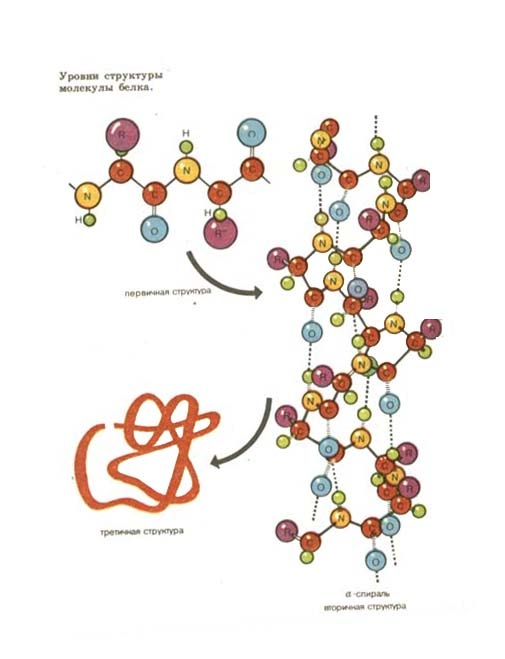
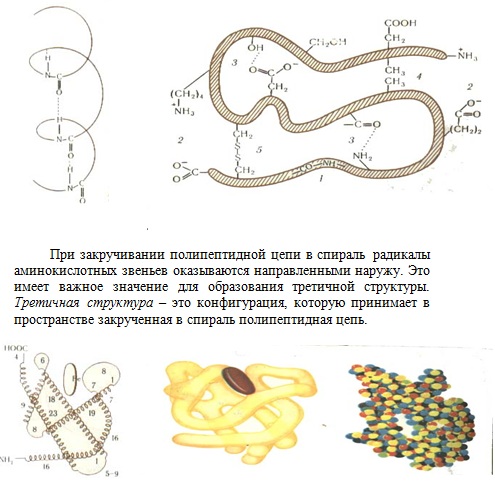
Третичная структура поддерживается взаимодействием между функциональными группами радикалов полипептидной цепи. Например, при сближении карбоксильной и аминогруппы может образоваться солевой мостик, карбоксильная группа с гидроксилом даёт сложноэфирный мостик, атомы серы образуют дисульфидные мостики (-S-S-) и т.д.
Третичная структура в виде определённой пространственной конфигурации с выступами и впадинами, с обращёнными наружу функциональными группами обуславливает специфическую активность белковой молекулы.
Из-за наличия разнообразных функциональных групп белок нельзя отнести к какому-либо одному из известных нам классов органических соединений. В нём объединяются признаки разных классов, и в своём сочетании они дают совершенно новое качество. Белок – высшая форма развития органических веществ.

Свойства белков.
Имея столь сложное строение, белки обладают, естественно, и весьма разнообразными свойствами.
Одни белки, например белок куриного яйца, растворяются в воде, образуя коллоидные растворы, другие – в разбавленных растворах солей. Некоторые белки совсем не обладают свойством растворимости.
Наличие в молекулах белков (в радикалах аминокислотных звеньев) групп –COOH и –NH2 делает белки амфотерными.
Важное свойство белков подвергаться гидролизу нам уже известно. Гидролиз проводят при действии ферментов или путём нагревания белка с раствором кислоты или щелочи.
Под влиянием ряда факторов (нагревания, действия радиации, даже сильного встряхивания) может нарушиться конфигурация молекулы белка – её вторичная и третичная структура. Этот процесс называется денатурацией белка. Сущность его состоит в разрушении водородных связей, солевых и иных мостиков, поддерживающих вторичную и третичную структуру молекулы, вследствие чего она теряет специфическую пространственную форму, дезориентируется (рис) и утрачивает своё биологическое действие. Денатурация белка происходит при варке яиц, приготовлении пищи и т.д.
Сильное нагревание вызывает не только денатурацию белков, но и их разложение с выделением летучих продуктов.
Белки дают характерные цветные реакции, по которым их можно распознать среди других веществ. Например, если к раствору белка прилить концентрированный раствор азотной кислоты, то появляется жёлтое окрашивание (происходит нитрование бензольных колец). Эту реакцию можно наблюдать на коже рук при неосторожном обращении в лаборатории с азотной кислотой.
Превращение белков в организме.
Как указывалось, животные организмы строят свои белки из аминокислот тех белков, которые они получают с пищей. Поэтому наряду с жирами и углеводами белки – обязательный компонент нашей пищи.
В процессе переваривания пищи происходит гидролиз белков под влиянием ферментов. В желудке они расщепляются на более или менее крупные «осколки» - полипептиды, которые далее в кишечнике гидролизуются до аминокислот. Последние всасываются ворсинками кишечника в кровь и поступают во все ткани и клетки организма. В отличие от углеродов и жиров, аминокислоты в запас не откладываются.
Судьба аминокислот в организме различна. Основная их масса расходуется на синтез белков, которые идут на увеличение белковой массы организма при его росте и на обновление белков, распадающихся в процессе жизнедеятельности. Синтез белков идёт с поглощением энергии. Аминокислоты используются и для синтеза небелковых азотсодержащих соединений, например нуклеиновых кислот.
Часть аминокислот подвергаются постепенному распаду и окислению. При этом азот отщепляется в виде аммиака, который превращается в мочевину и выводится из организма с мочой. Углерод и водород окисляются до оксида углерода (VI) и воды. Эти процессы идут с выделением энергии. Однако в качестве энергетического источника белки имеют второстепенное значение, уступая в этом углеродам и жирам. Основная роль белков в организме иная. Теперь вы можете охарактеризовать её достаточно плотно.
Проблема синтеза белков.
Возможность получения белков путём химического синтеза давно волнует умы учённых, но только в последнее время определились успехи в этой области.
Почему же до сих пор белки не получают синтетически, подобно тому как получают другие высокомолекулярные вещества? Причина – в чрезвычайной сложности белковых молекул. Ведь чтобы получить заданный блок, необходимо выяснить его аминокислотный состав, установить первичную структуру, т.е. порядок чередования аминокислот, определить пространственную конфигурацию белковой молекулы, а затем искусственно воспроизвести это.
Установление аминокислотного состава белков путём их гидролиза – наиболее лёгкая задача.
Первый белок, у которого удалось расшифровать первичную структуру бы инсулин (1954 г.), регулирующий содержание сахара в крови. На установление порядка чередования аминокислот в инсулине было затрачено почти десять лет. Оказалось, что его молекула состоит из двух полипептидных цепочек, одна из которых содержит двадцать один аминокислотный остаток, а другая – тридцать; цепочки соединены между собой двумя дисульфидными мостиками (рис. 54).
В настоящее время расшифрована первичная структура уже значительного числа белков, в том числе и более сложного строения.
Синтез веществ белковой природы был впервые осуществлён на примере двух гормонов гипофиза (вазопрессина и окситоцина). Это полипептиды с небольшой молекулярной массой, состоящие каждый из девяти аминокислот. Большим научным достижением явился синтез инсулина и рибонуклеазы. О сложности таких синтезов свидетельствует тот факт, что для получения, например, одной из полипептидных цепочек потребовалось осуществить 89 реакций, а для другой – 138.
Функции белка
1. Строительная функция.
Весь организм человека, каждая его клетка состоит из белков (белки сухожилий, кожи, костей, мышц, крови, волос и т.д.)
Даже неклеточные формы жизни—вирусы состоят из молекулы белка и молекулы нуклеиновой кислоты.
Вирус табачной мозаики
2. Белки соединительной ткани выполняют механическую (опорную) функцию. Белки входят в состав скелета; они служат опорой тканям, выстилают кожу, обеспечивают прочность и эластичность кровеносных сосудов и трахей. В организме человека больше всего коллагена.
Полипептидная цепь коллагена—плотная левозакрученная спираль. Три спирали закручены в тройную спираль. Другой белок соединительной ткани—эластин.
3. Двигательная функция белков.
Белки преобразуют химическую энергию в механическую. Мышцы выполняют в организме двигательную и опорную функции. Сократительные белки—миозин и актин, которые расположены в миофибриллах мышц чередующимися участками. При сокращении мышц нити актина располагаются между нитями миозина, мышцы сокращаются и становятся толще.
Микротрубочки—элементы цитоплазмы клеток, которые играют роль в процессах внутриклеточного движения. Здесь присутствует белок тубулин.
4. Ферментативная функция (каталитическая).
Все ферменты—белки. Все реакции организма ферментативные, и ни одна из них не проходит без белка-фермента. Таким образом, белки—не только катализаторы, которые ускоряют реакцию, а в биологии реакция не пойдёт без фермента. Если вспомнить, что вся жизнедеятельность клетки, организма—это метаболизм химических реакций—оттуда и роль белка-фермента.
Ферменты обладают фантастической «производительностью».
Вспомним реакцию разложения перекиси водорода Н₂О₂ ферментом каталазой:
2Н₂О₂→2Н₂О + О₂↑
1 молекула каталазы за 1 секунду разлагает 100 тысяч молекул перекиси водорода.
Ферменты обладают высокой активностью, чувствительностью к изменению и специфичностью к осуществлению определённых реакций.
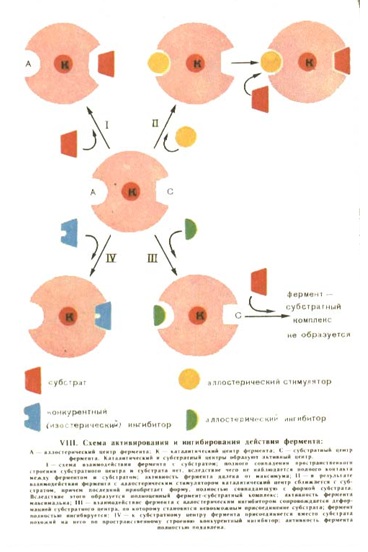
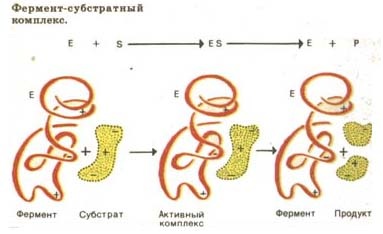
Э.Фишер сказал, что фермент и субстрат подходят друг к другу, как ключ к замку. То есть конфигурация молекулы субстрата должна подходить к конфигурации молекулы фермента. Фермент активен только на 3 уровне организации белковой молекулы.
Молекула-белка фермента огромна по сравнению с молекулой вещества, катализ которого она осуществляет. В молекуле фермента на 3 уровне организации возникает активный ферментативный центр, что и обеспечивает взаимодействие фермента и субстрата, причём входит он в реакцию неповрекждённым, что ранее давало повод считать, что он не принимает участия в реакции, что неверно.
Фермент образует фермент-субстратный комплекс.
Сейчас известно более 2000 ферментов.
5. Энергетическая функция белка.
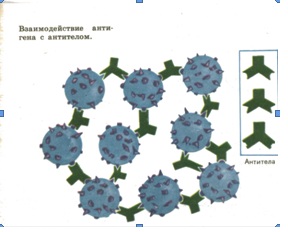
В крови человека присутствуют защитные белки—антитела, которые уничтожают инфекции. Они по своему действию делятся на антитела, которые осаждают инфекцию—преципитины, которые склеивают инфекцию—агглютинины, и которые расщепляют инфекцию—лизины. Антитела образуются при взаимодействии лейкоцита вследствие фагоцитоза, открытого И.И.Мечниковым в 1883 г., с антигеном. Таким образом, после болезни у человека образуются антитела против этого заболевания, и человек во второй раз, как правило, не заболевает. Открыли антитела немецкий бактериолог Эмиль Беринг и немецкий врач, биохимик Пауль Эрлих.
Защитное значение имеет белок фибриноген. При травме в присутствии солей кальция и при разрушении тромбоцитов выделяется активный фермент—тромбокиназа, который постепенно переводит растворимый в крови белок фибриноген в протромбин, потом—тромбин, фибрин и, наконец, фибриллярный белок глобулин, образующий белые нити белка, которые и создают тромб, закупоривающий кровеносный сосуд. Но надо иметь в виду, что те же иммунные белки играют роль при переливании крови. Если человеку перелить кровь не той группы, это вызовет смерть. Белки также обуславливают резус-фактор.
Организм вырабатывает очень много защитных белков. Один из них—интерферон, открытый в 1957 году английскими учёными. Молекула белка-антитела подходит к молекуле инфекции, как ключ к замку, и вызывает подавление инфекции.6. Белки-регуляторы.
Гомеостаз—это постонство среды в организме. Это постоянство удерживается динамическим равновесием, в котором важную роль играют белки. В динамическрм равновесии находятся и химические процессы, протекающие в организме. Для поддержания их в состоянии равновесия необходимы химичемкие регуляторы, каковыми являются белки.
7. Белки создают онкотическое давление, которое входит как составная часть как тургорного, так и осмотического.
8. Белки выполняют и гормональную функцию. Часть гормонов—белки. Например, инсулин—гормон поджелудочной железы, переводящий глюкозу в гликоген, который откладывается в печени. Пептидными гормонами являются также окситоцин и вазопрессин—гормоны гипофиза, регулирующие давление крови.
9. Секреторная функция
Многие секреты—вещества, выделяемые органами тела—также белковой природы. Каждое из них играет свою роль в жизнедеятельности.
10. Сигнальная функция.
Количество и состояние белков-ферментов служит сигналом к запуску реакций синтеза или расщепления.
11. Белки играют роль в образовании буферных систем.
Примером такой системы могут служить кровь, лимфа и т.д. Эта функция белков связана с гомеостазом. Давление, концентрация веществ в эритроците, лейкоците, других форменных элементах крови должно равняться в этих системах давлению и концентрации веществ плазмы, лимфы и т.д. Буферные системы исполняют в нашем организме жизненно важные функции.
12. Токсическая функция белка.
Питательные белки, расщепляясь, образуют конечные продукты реакции—Н₂О, СО₂, NH₃. Последний—аммиак—яд, он поступает в кровь и нейтрализуется печенью, то есть в печени он преобразуется в менее ядовитое вещество—мочевину, которая опять поступает в кровь и фильтруется почками. Таким образом, эти токсичные вещества выводятся из организма. Но распад белков даёт аммиак, поэтому в случае остановки почек человек умирает, так как токсичные продукты обмена веществ не выводятся из организма.
13. Денатурация белка.
Белок—уникальная структура. Молекула нативного белка—белка, который входит в состав живого организма, белка-фермента—может менять свой уровень переходя с одного уровня на другой, при этом никогда не разрывая цепь—первый уровень организации белковой молекулы. Такой процесс называется обратимой денатурацией. Так поступает белок-фермент. Он веёт катализ только на 3 уровне организации, когда образуется активный ферментативный центр. Когда концентрация вещества, катализ которого ведёт фермент, оказывается достаточной для клетки, то сама концентрация этого вещества так влияет на фермент, что он «раскручивает» клубок до спирали или цепи. В таком состоянии он вести катализ уже не может. Таким образом осуществляется прекращение синтеза вещества, которое, в свою очередь, может являться и ферментом. Как мы видим, белки участвуют в регуляторных и жизненно важных процессах организма. Но может быть необратимая денатурация—коагуляция белка, при этом разрывая первичная структура белка—цепь, нарушаются пептидные связи. Такой белок уже не нативной. Он присутствует в мёртвом организме, коагуляция происходит при действии на белок температуры выше +50°С, при сильной радиации, смерти организма и т.д.
О некоторых белках, в основном тех, которых являются защитой нашего организма, расскажут нам ученики.
1. Интерферон.
2. Гемоглобин.
Предмети > Хімія > Хімія 9 клас > Білки: склад і будова. Гідроліз, денатурація. > Білки: склад і будова. Гідроліз, денатурація. Реферати
|


















