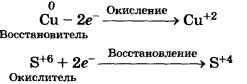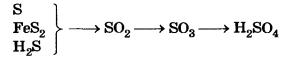|
Гипермаркет знаний>>Химия>>Химия 9 класс>> Химия: Соединения серы
Сероводород и сульфиды. Сероводород H2S — бесцветный газ с резким запахом. Очень ядовит, вызывает отравление даже при незначительном содержании в воздухе (около 0,01%). Сероводород тем более опасен, что он может накапливаться в организме. Он соединяется с железом гемоглобина крови, что может привести к обморочному состоянию и смерти от кислородного голодания. В присутствии паров органических веществ токсичность HgS резко возрастает.
Вместе с тем H2S имеет лечебное значение, он является составной частью некоторых минеральных вод (Пятигорск, Сер-новодск, Мацеста).
Сероводород содержится в вулканических газах и постоянно образуется на дне Черного моря. До верхних слоев сероводород не доходит, так как на глубине 150 м взаимодействует с проникающим сверху кислородом и окисляется им до серы. Сероводород образуется при гниении белка, поэтому, например, тухлые яйца пахнут сероводородом.
При растворении сероводорода с воде образуется слабая сероводородная кислота, соли которой называются сульфидами. Сульфиды щелочных и щелочноземельных металлов, а также сульфид аммония хорошо растворяются в воде, сульфиды остальных металлов нерастворимы и окрашены в различные цвета, например ZnS — белый, PbS — черный, MnS — розовый.
Сероводород горит. При охлаждении пламени (внесении в него холодных предметов) осаждается свободная сера:
2H2S + 02 = 2НгО + 2Si
Если же пламя не охлаждать и обеспечить избыток кислорода, то получается оксид серы(1У):
2H2S + 302 = 2Н2О + 2SО2
Химические свойства серной кислоты в значительной степени зависят от ее концентрации.
Разбавленная серная кислота проявляет все характерные свойства кислот: взаимодействует с металлами, стоящими в ряду напряжений до водорода, с выделением Н2, с оксидами металлов (основными и амфотерными), с основаниями и солями. Поскольку серная кислота двухосновна, она образует два ряда солей: средние — сульфаты и кислые — гидросульфаты, например NaHS04.
Реактивом на серную кислоту и ее соли является хлорид бария ВаС12; сульфат-ионы SO с ионами Ва 2+ образуют белый нерастворимый сульфат бария, выпадающий в осадок:
Ва2+ + SO = BaS04
Концентрированная серная кислота по свойствам сильно отличается от разбавленной кислоты. Так, при взаимодействии концентрированной Н^С^ с металлами водород не выделяется, поскольку окислителем выступают уже не катионы водорода Н+, как в случае разбавленной кислоты, а сульфат-ионы S0|~. С металлами, стоящими правее водорода в ряду напряжений (медью, ртутью и др.), реакция протекает следующим образом:
Си + 2H2S04(KOH4) = CuS04 + S02+ 2Н20
Процессы окисления и восстановления, происходящие при этом, можно записать так:
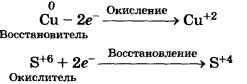
При взаимодействии с металлами, находящимися в ряду напряжений до водорода, концентрированная H2S04 восстанавливается до S, S02 или H2S в зависимости от положения металла в ряду напряжений и условий протекания реакции, например:
4Zn + 5H2S04(KOH4) = 4ZnS04 + H2St + 4НгО
Теперь вам понятно, что с H2S04(KOH) взаимодействуют металлы, стоящие в ряду напряжений как до водорода, так и после него. При этом водород не образуется, так как окислителем в такой реакции являются не катионы водорода Н+, как у разбавленной кислоты, а сульфат-ионы S0.
Железо и алюминий пассивируются концентрированной серной кислотой, т. е. покрываются защитной пленкой, поэтому концентрированную кислоту можно перевозить в стальных и алюминиевых цистернах.
Будучи нелетучей сильной кислотой, Н2SO4(конц) способна вытеснять другие кислоты из их солей. Вы уже знаете такую реакцию, например получение хлороводорода:
2NаС1 + Н28O4(конц) = Nа2S04 + 2НСl
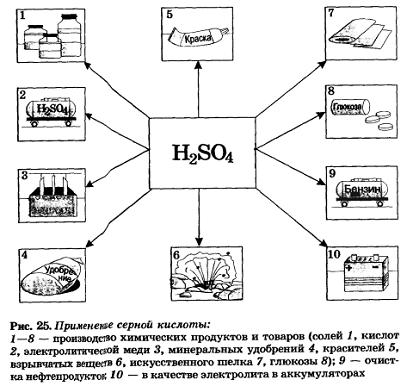
Серная кислота — один из важнейших продуктов, используемых в различных отраслях промышленности. Основными ее потребителями являются производство минеральных удобрений, металлургия, очистка нефтепродуктов. Серная кислота применяется также в производстве других кислот, моющих средств, взрывчатых веществ, лекарств, красок, в качестве электролита для свинцовых аккумуляторов (рис. 25).
Из солей серной кислоты наибольшее значение имеют уже известные вам кристаллический сульфат натрия, или глауберова соль Na2SO4 • 10Н20, гипс СаSO4 • 2Н2О и сульфат бария ВаSO4 (где они применяются?).
Медный купорос СuS04 • 5Н2О используется в сельском хозяйстве для борьбы с вредителями и болезнями растений.
Производство серной кислоты. Получают серную кислоту в три стадии:
1. Получение SO2. В качестве сырья применяют серу, колчедан или сероводород.
2. Получение SO3. Этот процесс вам уже известен — окисление кислородом проводят с помощью катализатора.
3. Получение Н2SO4. А вот здесь, в отличие от известной вам реакции, описываемой уравнением SO3 + Н2O - Н2SO4, процесс растворения оксида серы(VI) проводят не в воде, а в концентрированной серной кислоте, при этом получается знакомый вам олеум.
Химические процессы производства серной кислоты можно представить в виде следующей схемы:
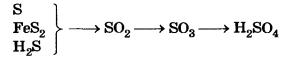
Схема производства серной кислоты представлена на рисунке 26.
Первую стадию проводят в печи для обжига в кипящем слое, так как обжиг колчедана — процесс гетерогенный. Перед обжигом колчедан размалывают и подают в печь ленточными транспортерами. В обжиговой печи через размолотый колчедан пропускают сильную струю воздуха. Частицы колчедана оказываются во взвешенном состоянии, создавая иллюзию кипящей жидкости, что и дало название — метод кипящего слоя.
Полученный оксид серы(IV) направляют на очистку от крупной пыли в циклон, от мелкой пыли — в электрофильтр, затем осушают в сушильной башне, промывая его серной кислотой. После этого очищенный и осушенный газ подогревают в теплообменнике.
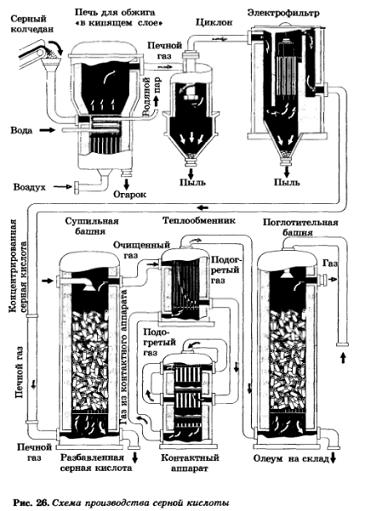
Вторую стадию — получение SO3 — проводят в контактном аппарате. В нем на специальных полочках-решетках размещают слоями катализатор, созданный на основе оксида ванадия(V) — V2O5. Между слоями катализатора располагают трубки теплообменника, по которым подается обжиговый газ для подогрева. При этом одновременно решается проблема нагревания SO2 и охлаждения до необходимой температуры SO3. Такой принцип — принцип теплообмена широко применяется на химическом производстве. Выходящий из контактного аппарата газ направляется в трубки теплообменника для дальнейшего охлаждения и передачи теплоты очищенному и осушенному SO2.
Для третьей стадии — поглощения SO3 — воду не применяют, так как из-за выделяющейся теплоты вода превращается в пар и серная кислота образуется в виде капелек тумана. Поэтому SO3 в поглотительной башне растворяют в концентрированной серной кислоте. Поглощение SO3 серной кислотой — процесс гетерогенный, и для создания большей поверхности соприкосновения поглотительную башню заполняют кольцами из огнеупорной керамики. Кислота, стекая сверху, омывает большое число колец (принцип противотока), создавая тем самым большую площадь соприкосновения с SO3. Полученный олеум направляется на склад готовой продукции.
Производство серной кислоты создает немало экологических проблем. Выбросы и отходы сернокислотных заводов вызывают крайне негативное воздействие на окружающую среду: увеличение заболеваний дыхательной системы у человека и животных, гибель растительности и подавление ее роста, повышение коррозионного износа материалов, разрушение сооружений из известняка и мрамора, закисление почв и др.
1. Сероводород и сульфиды.
2. Сернистый газ, сернистая кислота, сульфиты.
3. Серная кислота, разбавленная и концентрированная.
4. Получение серной кислоты.
5. Применение сериой кислоты.
6. Соли серной кислоты: глауберова соль, гипс, сульфат бария, медный купорос.
7. Научные принципы производства.
Какое из веществ проявляет только восстановительные, только окислительные или и окислительные и восстановительные свойства: сера, сероводород, оксид серы(IV), серная кислота? Почему? Подтвердите свой ответ уравнениями соответствующих реакций.
К следующему уроку приготовьте задание, в котором вы должны охарактеризовать а) сернистый газ; б) оксид серы(VI) по плану: получение, свойства, применение. Напишите уравнения соответствующих реакций.
Напишите уравнения реакций, характеризующих свойства разбавленной серной кислоты как электролита. Какое свойство проявляется в окислительно-восстановительных реакциях? Какие реакции можно отнести к реакциям ионного обмена? Рассмотрите их с позиций представлений об окислительно-восстановительных процессах и теории электролитической диссоциации.
Напишите уравнения реакций, лежащих в основе получения серной кислоты, согласно приведенной в параграфе схеме.
В 400 мл воды растворили 11,2 л сернистого газа. Какова массовая доля сернистой кислоты в полученном растворе?
Дайте характеристику реакции синтеза оксида серы(VI), используя все известные вам классификации химических реакций, и рассмотрите условия смещения химического равновесия вправо.
В 5 л воды растворили 500 г медного купороса. Какова массовая доля сульфата меди(II) в полученном растворе?
Почему серную кислоту называют «хлебом промышленности»?
словарь терминов по химии 9 класса, шпаргалки по химии, исправления и дополнения к урокам
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|