|
|
|
| Строка 1: |
Строка 1: |
| - | <metakeywords>хімія, 11 клас, руок, на Тему, Органічні сполуки</metakeywords>ОРГАНІЧНІ СПОЛУКИ<br><br>Минулого навчального року ви вивчали органічні сполуки, побудовані з атомів елементів Карбону і Гідрогену (раніше їх називали вуглець і водень) — вуглеводні. Довідалися про склад, структуру, властивості, застосування насичених, не насичених, ароматичних вуглеводнів, про їхні природні джерела— газ, нафту, кам'яне вугілля.<br>• Наведіть приклади сполук названих груп вуглеводнів, їхні формули і назви.<br>• Що таке нафта? Які продукти можна добути з неї?<br>Карбонові скелети є основою будови молекул інших хласів органічних речовин, у складі яких крім атомів Карбону й Гідрогену містяться атоми Оксигену й Нітрогену. Ці атоми надають речовинам специфічних властивостей, відмінних від властивостей вуглеводнів.<br>Оксигено- й нітрогеновмісні сполуки відіграють визначальну роль у функціонуванні живих організмів, уходять до складу їжі (це відомі вам з біології людини жири, білки, вуглеводи, вітаміни), є основою деревини, з якої виробляють папір, натуральних і хімічних волокон, мила, ліків, барвників тощо.<br>Знайомі всім терміни — спирт, оцтова кислота, естер — це назви оксигеновмісних органічних речовин порівняно простої будови. Саме з них ми й починаємо вивчення нового розділу кУрсу хімії.<br> | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 11 клас|Хімія 11 клас]]>>Хімія: Органічні сполуки'''<metakeywords>хімія, 11 клас, руок, на Тему, Органічні сполуки</metakeywords> |
| | + | |
| | + | <br> ОРГАНІЧНІ СПОЛУКИ<br><br>Минулого навчального року ви вивчали органічні сполуки, побудовані з атомів елементів Карбону і Гідрогену (раніше їх називали вуглець і водень) — вуглеводні. Довідалися про склад, структуру, властивості, застосування насичених, не насичених, ароматичних вуглеводнів, про їхні природні джерела— газ, нафту, кам'яне вугілля.<br>• Наведіть приклади сполук названих груп вуглеводнів, їхні формули і назви.<br>• Що таке нафта? Які продукти можна добути з неї?<br>Карбонові скелети є основою будови молекул інших хласів органічних речовин, у складі яких крім атомів Карбону й Гідрогену містяться атоми Оксигену й Нітрогену. Ці атоми надають речовинам специфічних властивостей, відмінних від властивостей вуглеводнів.<br>Оксигено- й нітрогеновмісні сполуки відіграють визначальну роль у функціонуванні живих організмів, уходять до складу їжі (це відомі вам з біології людини жири, білки, вуглеводи, вітаміни), є основою деревини, з якої виробляють папір, натуральних і хімічних волокон, мила, ліків, барвників тощо.<br>Знайомі всім терміни — спирт, оцтова кислота, естер — це назви оксигеновмісних органічних речовин порівняно простої будови. Саме з них ми й починаємо вивчення нового розділу кУрсу хімії.<br> |
| | | | |
| | <br> | | <br> |
| | | | |
| - | НАСИЧЕНІ ОДНОАТОМНІ СПИРТИ<br>Склад і будова молекул спиртів. Як уже зазначалося, молекули органічних сполук, крім атомів Карбону і Гідрогену, можуть містити атоми Оксигену. Уявімо, що в молекулі метану один атом Гідрогену заміщений гідроксильною групою. Хімічна будова такої сполуки — метанолу — виражається структурною формулою:<br>Н<br>Н-<br>-с-<br> н<br>-О-Н, або скорочено СН3—ОН, або СН3ОН<br>Заміщуючи атом Гідрогену в молекулі етану, дістанемо сполуку етанол такої хімічної будови:<br>або СН3—СН2—ОН, або С2Н5ОН<br>У цих сполуках вуглеводневі радикали метил —СН3 й етил —С2Н5 з'єднані з гідроксильною групою —ОН. Наявність останньої є ознакою класу органічних речовин, що називаються спиртами.<br>Загальну формулу насичених одноатомних спиртів можна вивести із загальної формули насичених вуглеводнів шляхом заміщення атома Гідрогену на гідроксильну групу.<br>Загальна формула насичених вуглеводнів<br>СпН2и+іОН<br>Загальна формула насичених одноатомних спиртів<br>Якщо вуглеводневий радикал позначити літерою Я, загальна формула спиртів позначається як К.—ОН.<br>Оскільки до складу молекул наведених спиртів входить одна гідроксильна група, такі спирти належать до одноатомних. Далі ви довідаєтеся про існування багатоатомних (двох-, трьохатомних і т. д.) спиртів.<br><br>Атом Оксигену як більш електронегативного елемента відтягує на себе електронну густину зв'язку О—Н. У результаті такого зміщення цей зв'язок поляризується, на атомі Гідрогену утворюється частковий позитивний заряд, а на атомі Оксигену — частковий негативний заряд (позначається грецькою літерою дельта 5):<br><br>У такому разі говорять, що молекула полярна. Полярність спиртів зумовлює їхні фізичні та хімічні властивості<br>Насичені одноатомні спирти утворюють гомологічний ряд<br><br> [[Image:Byba.jpeg]]<br> <br><br><br>• Які гомологічні ряди вам відомі? Чим відрізняються гомологи''Напишіть структурні формули наведених у табл. 1 сполук. Доведіть, що вони є гомологами.<br>атом Гідрогену атом Карбону атом Оксигену<br>Мал. 1. Моделі молекул метанолу (а) й етанолу (б)<br><br><br> Таблиця 1. Насичені одноатомні спирти<br><br>[[Image:Ximki.jpeg]]<br><br> '' Насиченим одноатомним спиртам властива ізомерія, спри¬чинена будовою карбонового скелета і положенням гідро¬ксильної групи.<br>• Пригадайте, що таке ізомерія. Напишіть формули ізомерів складу<br>С4Н10.''<br>[[Image:ximki1.jpeg]]'' | + | НАСИЧЕНІ ОДНОАТОМНІ СПИРТИ<br>Склад і будова молекул спиртів. Як уже зазначалося, молекули органічних сполук, крім атомів Карбону і Гідрогену, можуть містити атоми Оксигену. Уявімо, що в молекулі метану один атом Гідрогену заміщений гідроксильною групою. Хімічна будова такої сполуки — метанолу — виражається структурною формулою:<br>Н<br>Н-<br>-с-<br> н<br>-О-Н, або скорочено СН3—ОН, або СН3ОН<br>Заміщуючи атом Гідрогену в молекулі етану, дістанемо сполуку етанол такої хімічної будови:<br>або СН3—СН2—ОН, або С2Н5ОН<br>У цих сполуках вуглеводневі радикали метил —СН3 й етил —С2Н5 з'єднані з гідроксильною групою —ОН. Наявність останньої є ознакою класу органічних речовин, що називаються спиртами.<br>Загальну формулу насичених одноатомних спиртів можна вивести із загальної формули насичених вуглеводнів шляхом заміщення атома Гідрогену на гідроксильну групу.<br>Загальна формула насичених вуглеводнів<br>СпН2и+іОН<br>Загальна формула насичених одноатомних спиртів<br>Якщо вуглеводневий радикал позначити літерою Я, загальна формула спиртів позначається як К.—ОН.<br>Оскільки до складу молекул наведених спиртів входить одна гідроксильна група, такі спирти належать до одноатомних. Далі ви довідаєтеся про існування багатоатомних (двох-, трьохатомних і т. д.) спиртів.<br><br>Атом Оксигену як більш електронегативного елемента відтягує на себе електронну густину зв'язку О—Н. У результаті такого зміщення цей зв'язок поляризується, на атомі Гідрогену утворюється частковий позитивний заряд, а на атомі Оксигену — частковий негативний заряд (позначається грецькою літерою дельта 5):<br><br>У такому разі говорять, що молекула полярна. Полярність спиртів зумовлює їхні фізичні та хімічні властивості<br>Насичені одноатомні спирти утворюють гомологічний ряд<br><br> [[Image:Byba.jpeg]]<br> <br><br><br>• Які гомологічні ряди вам відомі? Чим відрізняються гомологи''Напишіть структурні формули наведених у табл. 1 сполук. Доведіть, що вони є гомологами.<br>атом Гідрогену атом Карбону атом Оксигену<br>Мал. 1. Моделі молекул метанолу (а) й етанолу (б)<br><br><br> Таблиця 1. Насичені одноатомні спирти<br><br>[[Image:Ximki.jpeg]]<br><br> '' Насиченим одноатомним спиртам властива ізомерія, спри¬чинена будовою карбонового скелета і положенням гідро¬ксильної групи.<br>• Пригадайте, що таке ізомерія. Напишіть формули ізомерів складу<br>С4Н10.''<br>[[Image:Ximki1.jpeg]]'' |
| | | | |
| - | ''<br>''Міжнародні назви спиртів утворюють від назв відповідних вуглеводнів додаванням суфікса -ол. Щоб дати назву спирту, треба пронумерувати карбоновий ланцюг, починаючи від гідроксильної групи, перед назвою вказати місце і назву радикалу, після назви — місце гідроксильної групи.<br>Фізичні властивості метанолу й етанолу. Метанол і етанол за нормальних умов — рідини, легші за воду, мають специфічний запах, як полярні, сполуки, вони добре розчинні у воді метанолу дорівнює 65 °С, етанолу — 78 °С.<br>• Вода — полярний розчинник. Пригадайте розчинність неполярних насичених вуглеводнів, порівняйте її з розчинністю полярних спиртів. Зробіть висновок.<br>Метиловий спирт — дуже отруйна рідина, у разі потрапляння в організм 10 мл метанолу спричинюють сліпоту, а 25 мл — смерть.<br>Етиловий спирт за дією на організм є наркотиком, що в невеликих дозах спричинює сп'яніння, у великих — навіть смерть. Зловживання напо/ями, що містять етанол (інакше алкоголь), викликає страшне захворювання — алкоголізм.<br>Метанол і етанол — дуже подібні рідини, розрізнити їх можна лише хімічним способом або за температурою кипіння. Трапляються випадки, коли люди помилково вживають метанол замість етанолу, щ0 призводить до трагічних наслідків. <br>Хімічні властивості метанолу й етанолу. Спирти, як і всі<br>органічні сполуки, горять. Метанол і етанол миттєво спалахують при підпалюванні й горять синюватим, майже непомітним полум'ям із виділенням великої кількості теплоти. Відбувається реакція повного окиснення:<br>2СН3—ОН + 302-----> 2С02 + 4Н20; Дж= -715 кДж/моль<br>• Напишіть рівняння реакції горіння етанолу.<br>Завдяки тому, що електронна густина зв'язку О—Н зміщена до атома Оксигену, атом Гідрогену набуває більшої рухливості й легше відщеплюється. Під дією активних металів, таких як натрій, калій, магній, алюміній, відбувається заміщення атома Гідрогену на атом металу.<br>У пробірку з етиловим спиртом покладемо шматочки натрію. Одразу відбувається реакція з виділенням газу. Це водень.<br>• Пригадайте, як його можна виявити.<br><br>Етилат натрію<br>Якщо краплю розчину з пробірки перенести на скло і випарити, то на склі утворяться кристали етилату.<br>• Напишіть рівняння реакції метанолу з калієм. Назвіть продукт реакції.<br>Реакції спиртів можуть відбуватися і з відщепленням гідроксильної групи. Спирти взаємодіють з галогеноводнями. Наприклад, якщо сухий галогеноводень пропускати крізь спирт або нагрівати спирт з концентрованим розчином хлоридної кислоти, відбувається реакція заміщення гідроксильної групи на галоген.<br><br>Хлоретан<br><br>• Напишіть рівняння реакції метанолу з бромоводнем. Назвіть продукт реакції.<br>Якщо етанол нагрівати вище 170 °С за наявності концентрованої сульфатної кислоти, відбувається реакція дегідратації (відщеплення води), спирт перетворюється на ненасичений вуглеводень етилен.<br>Про деякі інші властивості спиртів ви дізнаєтеся далі.<br>Як ви могли переконатися, властивості (функції) спиртів визначаються наявністю гідроксильної групи. Така група називається функціональною. У молекулах органічних сполук можуть міститись одна або кілька різних чи однакових функціональних груп.<br>Застосування метанолу й етанолу. Метиловий спирт був уперше добутий у XVII ст., а вивчений у першій половині XIX ст. Його називають ще деревним спиртом за першим із відомих методів добування, а саме шляхом сухої перегонки деревини.<br>Етиловий спирт, етанол, винний спирт, алкоголь — назви-синоніми однієї сполуки, що є основою алкогольних напоїв і найвідоміша із класу спиртів. Археологічні розкопки засвідчують, що в епоху найдавніших цивілізацій уміли виробляти вино й пиво. Скидається на те, що алкоголь був найпершою сполукою, синтезованою людиною. Перша літературна згадка про власне етиловий спирт як «горючу воду», добуту перегонкою вина, відноситься до VIII ст., а елементний склад етанолу було з'ясовано на початку ХІХ ст.<br>Метанол і етанол — розчинники. Ця їхня властивість використовується в органічному синтезі та лабораторній практиці. Етанол як розчинник застосовується у фармації, медицині (екстрагування, виготовлення настоянок тощо), харчовій промисловості.<br>За допомогою хімічних перетворень із цих спиртів добувають речовини, що є вихідними для виробництва пластмас і каучуку.<br>Етанол використовується для синтезу оцтової кислоти, у суміші з бензином — як пальне.<br>Завдання для самоконтролю<br>1. Які сполуки називаються спиртами?<br>2. Що таке функціональна група?<br>3. Чим зумовлена ізомерія спиртів?<br>4. Серед наведених формул знайдіть формули ізомерів і гомологів:<br>(1) СН3—СН—СН2—СН3 (2) СН3—СН,—СН2—СН2—ОН<br>ОН<br>(3) СН3—ОН (4) СН2—СН2—СН2—СН2<br>СН3 ОН<br><br>До яких сполук належать спирти — до хімічно активних чи інертних? Чим визначається їхня поведінка? Поясніть на основі електронних уявлень.<br>6. У результаті добування етилату натрію масою 68 г виділився водень (н. у.) об'ємом<br>(1) 22,4 л; (2) 11,2 л; (3) 44,8 л; (4) 5,6 л.<br>(Ш Напишіть рівняння послідовного перетворення етанолу на<br>Як трьома/способами добути хлоретан? Напишіть рівняння<br><br><br> ГЛІЦЕРИН <br>Склад і будова молекули гліцерину. Крім одноатомних спиртів, тобто тих, що містять у молекулі одну функціональну групу, існують багатоатомні спирти, до скла,ду_яких входять двіібільше гідроксильні групи. До них належить гліцерин — трьохатомний спирт. Структурна формула гліцерину<br><br>Н-С-С-С-Н, або скорочено СН2—СН-СН2 III <br>ОН ОН ОН ОН ОН ОН<br>Фізичні властивості гліцерину. Це густа сиропоподібна рідина без запаху і кольору, солодка на смак, добре розчинна у воді. Властивості гліцерину відображає його назва «олійний цукор», вживана у^УПІ ст., коли гліцерин було добуто вперше з маслинової<br>
| + | ''<br>''Міжнародні назви спиртів утворюють від назв відповідних вуглеводнів додаванням суфікса -ол. Щоб дати назву спирту, треба пронумерувати карбоновий ланцюг, починаючи від гідроксильної групи, перед назвою вказати місце і назву радикалу, після назви — місце гідроксильної групи.<br>Фізичні властивості метанолу й етанолу. Метанол і етанол за нормальних умов — рідини, легші за воду, мають специфічний запах, як полярні, сполуки, вони добре розчинні у воді метанолу дорівнює 65 °С, етанолу — 78 °С.<br>• Вода — полярний розчинник. Пригадайте розчинність неполярних насичених вуглеводнів, порівняйте її з розчинністю полярних спиртів. Зробіть висновок.<br>Метиловий спирт — дуже отруйна рідина, у разі потрапляння в організм 10 мл метанолу спричинюють сліпоту, а 25 мл — смерть.<br>Етиловий спирт за дією на організм є наркотиком, що в невеликих дозах спричинює сп'яніння, у великих — навіть смерть. Зловживання напо/ями, що містять етанол (інакше алкоголь), викликає страшне захворювання — алкоголізм.<br>Метанол і етанол — дуже подібні рідини, розрізнити їх можна лише хімічним способом або за температурою кипіння. Трапляються випадки, коли люди помилково вживають метанол замість етанолу, щ0 призводить до трагічних наслідків. <br>Хімічні властивості метанолу й етанолу. Спирти, як і всі<br>органічні сполуки, горять. Метанол і етанол миттєво спалахують при підпалюванні й горять синюватим, майже непомітним полум'ям із виділенням великої кількості теплоти. Відбувається реакція повного окиснення:<br>2СН3—ОН + 302-----> 2С02 + 4Н20; Дж= -715 кДж/моль<br>• Напишіть рівняння реакції горіння етанолу.<br>Завдяки тому, що електронна густина зв'язку О—Н зміщена до атома Оксигену, атом Гідрогену набуває більшої рухливості й легше відщеплюється. Під дією активних металів, таких як натрій, калій, магній, алюміній, відбувається заміщення атома Гідрогену на атом металу.<br>У пробірку з етиловим спиртом покладемо шматочки натрію. Одразу відбувається реакція з виділенням газу. Це водень.<br>• Пригадайте, як його можна виявити.<br><br>Етилат натрію<br>Якщо краплю розчину з пробірки перенести на скло і випарити, то на склі утворяться кристали етилату.<br>• Напишіть рівняння реакції метанолу з калієм. Назвіть продукт реакції.<br>Реакції спиртів можуть відбуватися і з відщепленням гідроксильної групи. Спирти взаємодіють з галогеноводнями. Наприклад, якщо сухий галогеноводень пропускати крізь спирт або нагрівати спирт з концентрованим розчином хлоридної кислоти, відбувається реакція заміщення гідроксильної групи на галоген.<br><br>Хлоретан<br><br>• Напишіть рівняння реакції метанолу з бромоводнем. Назвіть продукт реакції.<br>Якщо етанол нагрівати вище 170 °С за наявності концентрованої сульфатної кислоти, відбувається реакція дегідратації (відщеплення води), спирт перетворюється на ненасичений вуглеводень етилен.<br>Про деякі інші властивості спиртів ви дізнаєтеся далі.<br>Як ви могли переконатися, властивості (функції) спиртів визначаються наявністю гідроксильної групи. Така група називається функціональною. У молекулах органічних сполук можуть міститись одна або кілька різних чи однакових функціональних груп.<br>Застосування метанолу й етанолу. Метиловий спирт був уперше добутий у XVII ст., а вивчений у першій половині XIX ст. Його називають ще деревним спиртом за першим із відомих методів добування, а саме шляхом сухої перегонки деревини.<br>Етиловий спирт, етанол, винний спирт, алкоголь — назви-синоніми однієї сполуки, що є основою алкогольних напоїв і найвідоміша із класу спиртів. Археологічні розкопки засвідчують, що в епоху найдавніших цивілізацій уміли виробляти вино й пиво. Скидається на те, що алкоголь був найпершою сполукою, синтезованою людиною. Перша літературна згадка про власне етиловий спирт як «горючу воду», добуту перегонкою вина, відноситься до VIII ст., а елементний склад етанолу було з'ясовано на початку ХІХ ст.<br>Метанол і етанол — розчинники. Ця їхня властивість використовується в органічному синтезі та лабораторній практиці. Етанол як розчинник застосовується у фармації, медицині (екстрагування, виготовлення настоянок тощо), харчовій промисловості.<br>За допомогою хімічних перетворень із цих спиртів добувають речовини, що є вихідними для виробництва пластмас і каучуку.<br>Етанол використовується для синтезу оцтової кислоти, у суміші з бензином — як пальне.<br>Завдання для самоконтролю<br>1. Які сполуки називаються спиртами?<br>2. Що таке функціональна група?<br>3. Чим зумовлена ізомерія спиртів?<br>4. Серед наведених формул знайдіть формули ізомерів і гомологів:<br>(1) СН3—СН—СН2—СН3 (2) СН3—СН,—СН2—СН2—ОН<br>ОН<br>(3) СН3—ОН (4) СН2—СН2—СН2—СН2<br>СН3 ОН<br><br>До яких сполук належать спирти — до хімічно активних чи інертних? Чим визначається їхня поведінка? Поясніть на основі електронних уявлень.<br>6. У результаті добування етилату натрію масою 68 г виділився водень (н. у.) об'ємом<br>(1) 22,4 л; (2) 11,2 л; (3) 44,8 л; (4) 5,6 л.<br>(Ш Напишіть рівняння послідовного перетворення етанолу на<br>Як трьома/способами добути хлоретан? Напишіть рівняння<br><br><br> ГЛІЦЕРИН <br>Склад і будова молекули гліцерину. Крім одноатомних спиртів, тобто тих, що містять у молекулі одну функціональну групу, існують багатоатомні спирти, до скла,ду_яких входять двіібільше гідроксильні групи. До них належить гліцерин — трьохатомний спирт. Структурна формула гліцерину<br><br>Н-С-С-С-Н, або скорочено СН2—СН-СН2 III <br>ОН ОН ОН ОН ОН ОН<br>Фізичні властивості гліцерину. Це густа сиропоподібна рідина без запаху і кольору, солодка на смак, добре розчинна у воді. Властивості гліцерину відображає його назва «олійний цукор», вживана у^УПІ ст., коли гліцерин було добуто вперше з маслинової<br> |
| | | | |
| - | Лабораторна робота <br>Досліди з гліцерином<br>Дослід 1. РОЗЧИННІСТЬ гліцерину у воді. Змішайте у пробірці воду і гліцерин (приблизно по 1 мл). Додайте до суміші ще 1 мл гліцерину. Чи розчиняється він? Зробіть висновок про розчинність гліцерину у воді.<br>14<br>Хімічні властивості гліцерину.<br>Наявність гідроксильних груп зумов-лює подібність гліцерину до одноатомних спиртів, він вступає в ті самі оеакції, але за участю трьох гідро-ксильних груп.<br>Реакція повного окиснення (горіння) відбувається, як і в інших ор ганічнйх речовин, з утворенням вуг<br>лекислого газу і води.<br>Складіть рівняння реакції горіння гліцерину.<br> | + | Лабораторна робота <br>Досліди з гліцерином<br>Дослід 1. РОЗЧИННІСТЬ гліцерину у воді. Змішайте у пробірці воду і гліцерин (приблизно по 1 мл). Додайте до суміші ще 1 мл гліцерину. Чи розчиняється він? Зробіть висновок про розчинність гліцерину у воді.<br>14<br>Хімічні властивості гліцерину.<br>Наявність гідроксильних груп зумов-лює подібність гліцерину до одноатомних спиртів, він вступає в ті самі оеакції, але за участю трьох гідро-ксильних груп.<br>Реакція повного окиснення (горіння) відбувається, як і в інших ор ганічнйх речовин, з утворенням вуг<br>лекислого газу і води.<br>Складіть рівняння реакції горіння гліцерину.<br> |
| | | | |
| - | Модель молекули гліцерину<br>Гліцерин вступає в реакцію заміщення з металічним натрієм. У пробірку з гліцерином опустимо шматочок натрію, нагріємо. Реакція відбувається з виділенням водню.<br><br>У реакціях з галогеноводнями відбувається заміщення гідроксильних груп гліцерину на галоген.<br><br> Характерною реакцією гліцерину є утворення розчину синього кольору з гідроксидом купруму(П). | + | Модель молекули гліцерину<br>Гліцерин вступає в реакцію заміщення з металічним натрієм. У пробірку з гліцерином опустимо шматочок натрію, нагріємо. Реакція відбувається з виділенням водню.<br><br>У реакціях з галогеноводнями відбувається заміщення гідроксильних груп гліцерину на галоген.<br><br> Характерною реакцією гліцерину є утворення розчину синього кольору з гідроксидом купруму(П). |
| | | | |
| - | <br>Дослід 2. Взаємодія гліцерину з гідроксидом купруму(ІІ). У пробірку налийте 1 мл розчину гідроксиду натрію чи калію і додайте кілька крапель розчину сульфату купруму(ІІ). Спостерігайте утворення осаду гідроксиду купруму(ІІ). До осаду додайте гліцерин, суміш збовтайте. Спостерігайте утворення прозорого розчину синього кольору.<br>Продукт реакції має складну хімічну будову, тому ми не записуємо рівняння реакції.<br>Ця хімічна спроба слугує для виявлення багатоатомних спиртів.<br><br>Застосування гліцерину. Гліцерин — продукт, що має широке застосування. Завдяки гігроскопічності він використовується в парфумерії та фармації як зм'якшувальний засіб або основа мазей, добавка до мила, у харчовій промисловості — як добавка до напоїв. У шкіряному виробництві та текстильній промисловості — для обробки пряжі і шкіри з метою їх пом'якшення та надання еластичності. З гліцерину добувають вибухову речовину нітрогліцерин, що використовується для виготовлення динаміту Спиртовий розчин нітрогліцерину має судинорозширювальну дію й у вигляді ліків використовується при серцевих захворюваннях.<br>Завдання для самоконтролю<br>9. До якого класу сполук належить гліцерин? Чому?<br>10. Порівняйте склад і властивості етанолу й гліцерину. Чим зумовлена відмінність між цими сполуками?<br>11. Якщо в реакцію з гліцерином вступає натрій масою 69 г. виділяється водень об'ємом (н. у.)<br>(1) 22.4 л; (2) 44.8 л; (3) 33.6 л; (4) 11.2 л.<br>12. У двох пробірках містяться етанол і гліцерин. Як хімічним шляхом розрізнити ці рідини?<br>13. Двохатомний спирт етиленгліколь має формулу СЩ—СН2<br>ОН ОН і подібний за властивостями до гліцерину. Напишіть рівняння хімічних реакцій, що характеризують властивості етиленгліколю.<br>14. Чи відомий вам гліцерин із побутового застосування? Розкажіть про це.<br>15. Трускавецька мінеральна вода «Юзя» містить гліцерин. Здавна місцеві дівчата вмиваються нею «для краси». На яких власти-<br>востях, на вашу думку, заснована дія цієї води? <br><br>ФЕНОЛ<br>Склад і будова молекули фенолу. У разі, коли гідроксильна група сполучена безпосередньо з бензольним ядром, утворюється сполука фенол, представник класу фенолів. Молекулярна формула С6Н5—ОНу-структурна формула<br><br>Фенол — низькоплавна речовина<br><br>Фізичні властивості фенолу. Фенол — кристалічна речовина, безбарвна, має характерний запах. У разі зберігання в нещільно закритому посуді внаслідок окиснення набуває рожевого кольору (ТПЛ>42°С).<br>Помістимо пробірку з фенолом у посудину з гарячою водою: речовина розплавиться.<br>У холодній воді фенол розчиняється погано. Але якщо додати у пробірку з фенолом гарячої води, спостерігатиметься його швидке розчинення.<br>Хімічні властивості фенолу. За наявністю в молекулі фенолу гідроксильної групи можна припустити подібність між фенолом і спиртами, а за наявністю бен-<br><br>Модель молекули фенолу<br>• Пригадайте, як взаємодіє етанол з металічним натрієм. Складіть рівняння реакції.<br>Нагріємо фенол у пробірці до плавлення і помістимо в нього шматочки металічного натрію. Спостерігається виділення водню, утворюється також фенолят натрію в результаті реакції заміщення гідроксильного Гідрогену на Натрій;<br><br>Фенолят натрію<br>Отже, фенол реагує з натрієм так само, як спирти. Проте наявність у молекулі бензольного ядра зумовлює відмінність у хімічній поведінці фенолу і спиртів.<br>Наприклад, етанол не реагує з розчином лугу, а фенол вступає в цю реакцію, утворюючи фенолят:<br><br>Фенолят натрію<br>У цій реакції фенол поводить себе як кислота, що нейтралізує луг, утворюючи сіль і воду. Зважаючи на кислотні властивості фенолу, його називають ще карболовою кислотою, хоч це дуже слабка кислота.<br>Ми розглянули реакції фенолу за гідроксильною групою. Тепер розглянемо реакції за бензольним ядром.<br>Ви вже знаєте, що бензол не реагує з бромною водою. Якщо ж до розчину фенолу додати бромну воду, відбудеться реакція заміщення (бромування) з утворенням білого осаду трибромо-фенолу:<br><br>На прикладі реакцій фенолу ви ознайомилися з явищем взаємного впливу атомів у молекулі. Бензольне ядро так<br>впливає на гідроксильну групу, що полегшується відщеплення гідроксильного' Гідрогену і фенол виявляє кислотні властивості; гідроксильна група так впливає на бензольне ядро, що полегшується заміщення гідрогенових атомів ядра і фенол реагує з бромною водою.<br>Взаємний вплив атомів у молекулі має електронну природу і докладніше вивчається в повному курсі органічної хімії.<br>Характерною реакцією фенолу, за якою його можна виявити серед інших речовин, є реакція з розчином хлориду феру-му(Ш) Унаслідок зливання розчинів речовин утворюється сполука фіолетового кольору. її формула не наводиться через складність будови.<br>Застосування фенолу. Фенол було вперше виділено з кам'яновугільної смоли в першій половині XIX ст. Його застосування тісно пов'язане з розвитком синтетичної органічної хімії. Фенол є вихідною речовиною для виробництва барвників, лікувальних препаратів, пластичних мас, вибухових речовин.<br>Фенол має антисептичні властивості, які були виявлені ще у другій половині XIX ст. Вони зумовлюють використання його розчину (5%-го) для знезаражування приміщень, хірургічних інструментів, його добавляють до деяких сортів мила, ним протравлюють деревину, щоб запобігти її гниттю.<br>Разом з тим це токсична речовина, що може спричинити опіки шкіри. Оскільки фенол є продуктом коксохімічної промисловості, то вкупі з іншими промисловими викидами він потрапляє у стічні води, тим самим забруднює навколишнє середовище.<br>
| + | <br>Дослід 2. Взаємодія гліцерину з гідроксидом купруму(ІІ). У пробірку налийте 1 мл розчину гідроксиду натрію чи калію і додайте кілька крапель розчину сульфату купруму(ІІ). Спостерігайте утворення осаду гідроксиду купруму(ІІ). До осаду додайте гліцерин, суміш збовтайте. Спостерігайте утворення прозорого розчину синього кольору.<br>Продукт реакції має складну хімічну будову, тому ми не записуємо рівняння реакції.<br>Ця хімічна спроба слугує для виявлення багатоатомних спиртів.<br><br>Застосування гліцерину. Гліцерин — продукт, що має широке застосування. Завдяки гігроскопічності він використовується в парфумерії та фармації як зм'якшувальний засіб або основа мазей, добавка до мила, у харчовій промисловості — як добавка до напоїв. У шкіряному виробництві та текстильній промисловості — для обробки пряжі і шкіри з метою їх пом'якшення та надання еластичності. З гліцерину добувають вибухову речовину нітрогліцерин, що використовується для виготовлення динаміту Спиртовий розчин нітрогліцерину має судинорозширювальну дію й у вигляді ліків використовується при серцевих захворюваннях.<br>Завдання для самоконтролю<br>9. До якого класу сполук належить гліцерин? Чому?<br>10. Порівняйте склад і властивості етанолу й гліцерину. Чим зумовлена відмінність між цими сполуками?<br>11. Якщо в реакцію з гліцерином вступає натрій масою 69 г. виділяється водень об'ємом (н. у.)<br>(1) 22.4 л; (2) 44.8 л; (3) 33.6 л; (4) 11.2 л.<br>12. У двох пробірках містяться етанол і гліцерин. Як хімічним шляхом розрізнити ці рідини?<br>13. Двохатомний спирт етиленгліколь має формулу СЩ—СН2<br>ОН ОН і подібний за властивостями до гліцерину. Напишіть рівняння хімічних реакцій, що характеризують властивості етиленгліколю.<br>14. Чи відомий вам гліцерин із побутового застосування? Розкажіть про це.<br>15. Трускавецька мінеральна вода «Юзя» містить гліцерин. Здавна місцеві дівчата вмиваються нею «для краси». На яких власти-<br>востях, на вашу думку, заснована дія цієї води? <br><br>ФЕНОЛ<br>Склад і будова молекули фенолу. У разі, коли гідроксильна група сполучена безпосередньо з бензольним ядром, утворюється сполука фенол, представник класу фенолів. Молекулярна формула С6Н5—ОНу-структурна формула<br><br>Фенол — низькоплавна речовина<br><br>Фізичні властивості фенолу. Фенол — кристалічна речовина, безбарвна, має характерний запах. У разі зберігання в нещільно закритому посуді внаслідок окиснення набуває рожевого кольору (ТПЛ>42°С).<br>Помістимо пробірку з фенолом у посудину з гарячою водою: речовина розплавиться.<br>У холодній воді фенол розчиняється погано. Але якщо додати у пробірку з фенолом гарячої води, спостерігатиметься його швидке розчинення.<br>Хімічні властивості фенолу. За наявністю в молекулі фенолу гідроксильної групи можна припустити подібність між фенолом і спиртами, а за наявністю бен-<br><br>Модель молекули фенолу<br>• Пригадайте, як взаємодіє етанол з металічним натрієм. Складіть рівняння реакції.<br>Нагріємо фенол у пробірці до плавлення і помістимо в нього шматочки металічного натрію. Спостерігається виділення водню, утворюється також фенолят натрію в результаті реакції заміщення гідроксильного Гідрогену на Натрій;<br><br>Фенолят натрію<br>Отже, фенол реагує з натрієм так само, як спирти. Проте наявність у молекулі бензольного ядра зумовлює відмінність у хімічній поведінці фенолу і спиртів.<br>Наприклад, етанол не реагує з розчином лугу, а фенол вступає в цю реакцію, утворюючи фенолят:<br><br>Фенолят натрію<br>У цій реакції фенол поводить себе як кислота, що нейтралізує луг, утворюючи сіль і воду. Зважаючи на кислотні властивості фенолу, його називають ще карболовою кислотою, хоч це дуже слабка кислота.<br>Ми розглянули реакції фенолу за гідроксильною групою. Тепер розглянемо реакції за бензольним ядром.<br>Ви вже знаєте, що бензол не реагує з бромною водою. Якщо ж до розчину фенолу додати бромну воду, відбудеться реакція заміщення (бромування) з утворенням білого осаду трибромо-фенолу:<br><br>На прикладі реакцій фенолу ви ознайомилися з явищем взаємного впливу атомів у молекулі. Бензольне ядро так<br>впливає на гідроксильну групу, що полегшується відщеплення гідроксильного' Гідрогену і фенол виявляє кислотні властивості; гідроксильна група так впливає на бензольне ядро, що полегшується заміщення гідрогенових атомів ядра і фенол реагує з бромною водою.<br>Взаємний вплив атомів у молекулі має електронну природу і докладніше вивчається в повному курсі органічної хімії.<br>Характерною реакцією фенолу, за якою його можна виявити серед інших речовин, є реакція з розчином хлориду феру-му(Ш) Унаслідок зливання розчинів речовин утворюється сполука фіолетового кольору. її формула не наводиться через складність будови.<br>Застосування фенолу. Фенол було вперше виділено з кам'яновугільної смоли в першій половині XIX ст. Його застосування тісно пов'язане з розвитком синтетичної органічної хімії. Фенол є вихідною речовиною для виробництва барвників, лікувальних препаратів, пластичних мас, вибухових речовин.<br>Фенол має антисептичні властивості, які були виявлені ще у другій половині XIX ст. Вони зумовлюють використання його розчину (5%-го) для знезаражування приміщень, хірургічних інструментів, його добавляють до деяких сортів мила, ним протравлюють деревину, щоб запобігти її гниттю.<br>Разом з тим це токсична речовина, що може спричинити опіки шкіри. Оскільки фенол є продуктом коксохімічної промисловості, то вкупі з іншими промисловими викидами він потрапляє у стічні води, тим самим забруднює навколишнє середовище.<br> |
| | | | |
| | Завдання для самоконтролю <br>1 Схарактеризуйте подібні хімічні властивості фенолу й одноатомних спиртів.<br>2. Яка особливість хімічної будови фенолу зумовлює йото відмінність від представників класу спиртів? <br>3. До якого типу реакцій належить реакція фенолу з лугом?<br>4. У трьох пробірках містяться етанол, гліцерин, розчин фенолу. Як розрізнити вміст пробірок за фізичними і хімічними власти- ,<br>востями цих сполук. <br>5. У чому полягає вплив гідроксильної групи на власт<br>ивості<br>фенолу порівняно з бензолом?<br>6. До розчину феноляту натрію обережно краплями додають сульфатн>' кислоту. Розчин каламутніє. Чому? Складіть рівняння реакції.<br>7*. Речовина, що має будову НО тиме в реакції:<br>(1) з натрієм і з гідроксидом натрію;<br>(2) тільки з натрієм;<br>(3) тільки з гідроксидом натрію. <br><br>Альдегіди<br>Склад і будова молекул альдегідів. До класу альдегідів належать речовини, у молекулах яких функціональна альде-<br>гідна група —с сполучена з вуглеводневим радикалом (у<br>^Н найпростішої з цих речовин — з атомом Гідрогену). Загальна формула альдегідів<br>С„Н2п+1СНО, або К— СНО<br>Порівняно зі спиртами у складі молекул альдегідів на два атоми Гідрогену менше. Це відбивається у назві «альдегіди», що походить від слів «алкоголь» і «дегідрування», тобто де-гідрований алкоголь.<br>Назва першого члена гомологічного ряду — метаналь, або формальдегід, або мурашиний альдегід.<br><br>Наступний у гомологічному ряду — етаналь, або ацет-альдегід, або оцтовий альдегід.<br><br>Традиційні назви альдегідів походять від назв кислот, на які ці альдегіди перетворюються в результаті окиснення (у наведених прикладах — від мурашиної та оцтової кислот).<br>Міжнародні назви альдегідів утворюють від відомих вам назв вуглеводнів з додаванням суфікса -аль. Отже, наступний у гомологічному ряду — пропаналь<br>СНз СН2—Сч<br><br>Фізичні властивості ацетальдегіду. Це<br>летка безбарвна рідина, добре розчинна у воді, має різкий характерний запах.<br>Хімічні властивості ацетальдегіду. Подвійний зв'язок між атомами Карбону й Окси-гену в альдегідній групі поляризований за рахунок відтягування електронів до атома Окси-гену як більш електронегативного елемента. На ньому виникає частковий негативний заряд, а на атомі Карбону — частковий позитивний заряд:<br>Мал. 4. Модель молекули ацетальдегіду<br><br>Саме це визначає хімічну активність альдегідів. Вони легко вступають у реакції окиснення.<br><br>Часткове окиснення ацетальдегіду можна провести за допомогою гідроксиду купруму(И). До свіжоприготовленого осаду гідроксиду купруму(И), добутого внаслідок зливання розчинів сульфату купруму(И) і гідроксиду натрію, додамо розчин ацетальдегіду, нагріємо суміш. У пробірці утворюється жовтий осад гідроксиду купруму(І), що швидко розкладається на оксид купруму(І) червоного кольору і воду:<br><br>СН3—С + 2Си(ОН)2-----> СН3—С ч- 2СиОН + Н20<br><br>Оцтова кислота<br>2СиОН-----> Си20 + Н20<br>Окиснити ацетальдегід можна й іншим реактивом — аміачним розчином оксиду аргентуму(І). Внаслідок нагрівання у ретельно вимитій колбі суміші цього реактиву з оцтовим альдегідом на стінках посуду випадає осад металічного срібла, що вкриває стінки блискучим шаром. Через це реакція зветься реакцією «срібного дзеркала».<br><br>Наведені реакції характерні для альдегідів і використовуються з метою їх аналітичного визначення.<br>Зважаючи на те, що альдегідна група містить подвійний зв'язок, можна припустити, що альдегід вступатиме в реакцію приєднання за місцем цього зв'язку.<br> Для якої групи органічних речовин характерні реакції приєднання? Наведіть рівняння реакції гідрування.<br><br>Приєднуючи водень, ацетальдегід перетворюється на етиловий спирт:<br><br>сн3—с +н2 —> сн3—сн2—он<br> Етиловий спирт<br>Таким чином можна відновити альдегід до спирту. З іншого боку, спирт можна окиснити до альдегіду.<br><br>Лабораторна робота 2<br>Окиснення спирту до альдегіду<br>Мідну дротину розжарте в полум'ї спиртівки. Коли вона вкриється мідною окалиною (СиО), опустіть ЇЇ в пробірку з етиловим спиртом. Відчувається характерний запах оцтового альдегіду.<br>Зверніть увагу на колір мідної дротини — окалина відновлюється до металічної міді. Реакція відбувається за рівнянням:<br>СН3—СН2—ОН + СиО —-> СН3—С + Н20 + Си<br>ЕТИЛОВИЙ спирт<br>Оцтовий альдегід<br>• Доповніть свої записи в темі «Спирти» інформацією про властивість спиртів окиснюватись до альдегідів. Запишіть рівняння реакції.<br>Розглянуті реакції окиснення і відновлення важливі для здійснення взаємних перетворень речовин різних класів.<br>Застосування оцтового альдегіду. Реакції окиснення зумовлюють застосування цієї сполуки для добування оцтової кислоти.<br>У невеликих кількостях оцтовий альдегід утворюється під час обміну речовин в організмі людини, зокрема в результаті метаболізму алкоголю. Надлишок ацетальдегіду шкідливий і викликає неприємні відчуття, що використовується з метою лікування алкоголізму.''<br>'' | | Завдання для самоконтролю <br>1 Схарактеризуйте подібні хімічні властивості фенолу й одноатомних спиртів.<br>2. Яка особливість хімічної будови фенолу зумовлює йото відмінність від представників класу спиртів? <br>3. До якого типу реакцій належить реакція фенолу з лугом?<br>4. У трьох пробірках містяться етанол, гліцерин, розчин фенолу. Як розрізнити вміст пробірок за фізичними і хімічними власти- ,<br>востями цих сполук. <br>5. У чому полягає вплив гідроксильної групи на власт<br>ивості<br>фенолу порівняно з бензолом?<br>6. До розчину феноляту натрію обережно краплями додають сульфатн>' кислоту. Розчин каламутніє. Чому? Складіть рівняння реакції.<br>7*. Речовина, що має будову НО тиме в реакції:<br>(1) з натрієм і з гідроксидом натрію;<br>(2) тільки з натрієм;<br>(3) тільки з гідроксидом натрію. <br><br>Альдегіди<br>Склад і будова молекул альдегідів. До класу альдегідів належать речовини, у молекулах яких функціональна альде-<br>гідна група —с сполучена з вуглеводневим радикалом (у<br>^Н найпростішої з цих речовин — з атомом Гідрогену). Загальна формула альдегідів<br>С„Н2п+1СНО, або К— СНО<br>Порівняно зі спиртами у складі молекул альдегідів на два атоми Гідрогену менше. Це відбивається у назві «альдегіди», що походить від слів «алкоголь» і «дегідрування», тобто де-гідрований алкоголь.<br>Назва першого члена гомологічного ряду — метаналь, або формальдегід, або мурашиний альдегід.<br><br>Наступний у гомологічному ряду — етаналь, або ацет-альдегід, або оцтовий альдегід.<br><br>Традиційні назви альдегідів походять від назв кислот, на які ці альдегіди перетворюються в результаті окиснення (у наведених прикладах — від мурашиної та оцтової кислот).<br>Міжнародні назви альдегідів утворюють від відомих вам назв вуглеводнів з додаванням суфікса -аль. Отже, наступний у гомологічному ряду — пропаналь<br>СНз СН2—Сч<br><br>Фізичні властивості ацетальдегіду. Це<br>летка безбарвна рідина, добре розчинна у воді, має різкий характерний запах.<br>Хімічні властивості ацетальдегіду. Подвійний зв'язок між атомами Карбону й Окси-гену в альдегідній групі поляризований за рахунок відтягування електронів до атома Окси-гену як більш електронегативного елемента. На ньому виникає частковий негативний заряд, а на атомі Карбону — частковий позитивний заряд:<br>Мал. 4. Модель молекули ацетальдегіду<br><br>Саме це визначає хімічну активність альдегідів. Вони легко вступають у реакції окиснення.<br><br>Часткове окиснення ацетальдегіду можна провести за допомогою гідроксиду купруму(И). До свіжоприготовленого осаду гідроксиду купруму(И), добутого внаслідок зливання розчинів сульфату купруму(И) і гідроксиду натрію, додамо розчин ацетальдегіду, нагріємо суміш. У пробірці утворюється жовтий осад гідроксиду купруму(І), що швидко розкладається на оксид купруму(І) червоного кольору і воду:<br><br>СН3—С + 2Си(ОН)2-----> СН3—С ч- 2СиОН + Н20<br><br>Оцтова кислота<br>2СиОН-----> Си20 + Н20<br>Окиснити ацетальдегід можна й іншим реактивом — аміачним розчином оксиду аргентуму(І). Внаслідок нагрівання у ретельно вимитій колбі суміші цього реактиву з оцтовим альдегідом на стінках посуду випадає осад металічного срібла, що вкриває стінки блискучим шаром. Через це реакція зветься реакцією «срібного дзеркала».<br><br>Наведені реакції характерні для альдегідів і використовуються з метою їх аналітичного визначення.<br>Зважаючи на те, що альдегідна група містить подвійний зв'язок, можна припустити, що альдегід вступатиме в реакцію приєднання за місцем цього зв'язку.<br> Для якої групи органічних речовин характерні реакції приєднання? Наведіть рівняння реакції гідрування.<br><br>Приєднуючи водень, ацетальдегід перетворюється на етиловий спирт:<br><br>сн3—с +н2 —> сн3—сн2—он<br> Етиловий спирт<br>Таким чином можна відновити альдегід до спирту. З іншого боку, спирт можна окиснити до альдегіду.<br><br>Лабораторна робота 2<br>Окиснення спирту до альдегіду<br>Мідну дротину розжарте в полум'ї спиртівки. Коли вона вкриється мідною окалиною (СиО), опустіть ЇЇ в пробірку з етиловим спиртом. Відчувається характерний запах оцтового альдегіду.<br>Зверніть увагу на колір мідної дротини — окалина відновлюється до металічної міді. Реакція відбувається за рівнянням:<br>СН3—СН2—ОН + СиО —-> СН3—С + Н20 + Си<br>ЕТИЛОВИЙ спирт<br>Оцтовий альдегід<br>• Доповніть свої записи в темі «Спирти» інформацією про властивість спиртів окиснюватись до альдегідів. Запишіть рівняння реакції.<br>Розглянуті реакції окиснення і відновлення важливі для здійснення взаємних перетворень речовин різних класів.<br>Застосування оцтового альдегіду. Реакції окиснення зумовлюють застосування цієї сполуки для добування оцтової кислоти.<br>У невеликих кількостях оцтовий альдегід утворюється під час обміну речовин в організмі людини, зокрема в результаті метаболізму алкоголю. Надлишок ацетальдегіду шкідливий і викликає неприємні відчуття, що використовується з метою лікування алкоголізму.''<br>'' |
| | | | |
| | + | <br> ''Вислано читачаму з сайту''<br> |
| | | | |
| - | ''Вислано читачаму з сайту''<br>
| + | <br> <sub>Плани уроків хімії, [[Гіпермаркет Знань - перший в світі!|підручники онлайн]], електронні видання безкоштовно, навчальна програма, [[Гіпермаркет Знань - перший в світі!|скачати тести]] безкоштовно, календарне планування уроків хімії, готові домашні завдання</sub> |
| - | | + | |
| - | <br> | + | |
| | | | |
| | [[Image:1236084776 kr.jpg]] акселеративні методи на уроці [[Image:1236084776 kr.jpg]] національні особливості | | [[Image:1236084776 kr.jpg]] акселеративні методи на уроці [[Image:1236084776 kr.jpg]] національні особливості |
| Строка 39: |
Строка 40: |
| | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/forum/ коментарі та обговорення] [[Image:1236084776 kr.jpg|10x10px]] тематичні свята | | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/forum/ коментарі та обговорення] [[Image:1236084776 kr.jpg|10x10px]] тематичні свята |
| | [[Image:1236084776 kr.jpg|10x10px]] конспект уроку [[Image:1236084776 kr.jpg|10x10px]] тести | | [[Image:1236084776 kr.jpg|10x10px]] конспект уроку [[Image:1236084776 kr.jpg|10x10px]] тести |
| | + | |
| | + | Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам]. |
| | + | |
| | + | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум]. |
Версия 19:54, 12 октября 2009
Гіпермаркет Знань>>Хімія>>Хімія 11 клас>>Хімія: Органічні сполуки
ОРГАНІЧНІ СПОЛУКИ
Минулого навчального року ви вивчали органічні сполуки, побудовані з атомів елементів Карбону і Гідрогену (раніше їх називали вуглець і водень) — вуглеводні. Довідалися про склад, структуру, властивості, застосування насичених, не насичених, ароматичних вуглеводнів, про їхні природні джерела— газ, нафту, кам'яне вугілля.
• Наведіть приклади сполук названих груп вуглеводнів, їхні формули і назви.
• Що таке нафта? Які продукти можна добути з неї?
Карбонові скелети є основою будови молекул інших хласів органічних речовин, у складі яких крім атомів Карбону й Гідрогену містяться атоми Оксигену й Нітрогену. Ці атоми надають речовинам специфічних властивостей, відмінних від властивостей вуглеводнів.
Оксигено- й нітрогеновмісні сполуки відіграють визначальну роль у функціонуванні живих організмів, уходять до складу їжі (це відомі вам з біології людини жири, білки, вуглеводи, вітаміни), є основою деревини, з якої виробляють папір, натуральних і хімічних волокон, мила, ліків, барвників тощо.
Знайомі всім терміни — спирт, оцтова кислота, естер — це назви оксигеновмісних органічних речовин порівняно простої будови. Саме з них ми й починаємо вивчення нового розділу кУрсу хімії.
НАСИЧЕНІ ОДНОАТОМНІ СПИРТИ
Склад і будова молекул спиртів. Як уже зазначалося, молекули органічних сполук, крім атомів Карбону і Гідрогену, можуть містити атоми Оксигену. Уявімо, що в молекулі метану один атом Гідрогену заміщений гідроксильною групою. Хімічна будова такої сполуки — метанолу — виражається структурною формулою:
Н
Н-
-с-
н
-О-Н, або скорочено СН3—ОН, або СН3ОН
Заміщуючи атом Гідрогену в молекулі етану, дістанемо сполуку етанол такої хімічної будови:
або СН3—СН2—ОН, або С2Н5ОН
У цих сполуках вуглеводневі радикали метил —СН3 й етил —С2Н5 з'єднані з гідроксильною групою —ОН. Наявність останньої є ознакою класу органічних речовин, що називаються спиртами.
Загальну формулу насичених одноатомних спиртів можна вивести із загальної формули насичених вуглеводнів шляхом заміщення атома Гідрогену на гідроксильну групу.
Загальна формула насичених вуглеводнів
СпН2и+іОН
Загальна формула насичених одноатомних спиртів
Якщо вуглеводневий радикал позначити літерою Я, загальна формула спиртів позначається як К.—ОН.
Оскільки до складу молекул наведених спиртів входить одна гідроксильна група, такі спирти належать до одноатомних. Далі ви довідаєтеся про існування багатоатомних (двох-, трьохатомних і т. д.) спиртів.
Атом Оксигену як більш електронегативного елемента відтягує на себе електронну густину зв'язку О—Н. У результаті такого зміщення цей зв'язок поляризується, на атомі Гідрогену утворюється частковий позитивний заряд, а на атомі Оксигену — частковий негативний заряд (позначається грецькою літерою дельта 5):
У такому разі говорять, що молекула полярна. Полярність спиртів зумовлює їхні фізичні та хімічні властивості
Насичені одноатомні спирти утворюють гомологічний ряд
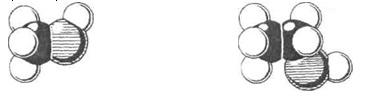
• Які гомологічні ряди вам відомі? Чим відрізняються гомологиНапишіть структурні формули наведених у табл. 1 сполук. Доведіть, що вони є гомологами.
атом Гідрогену атом Карбону атом Оксигену
Мал. 1. Моделі молекул метанолу (а) й етанолу (б)
Таблиця 1. Насичені одноатомні спирти
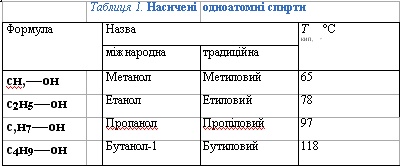
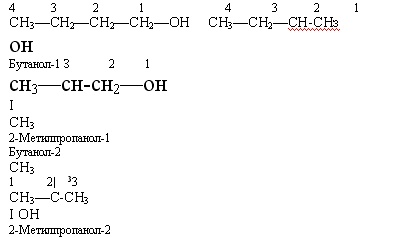
Насиченим одноатомним спиртам властива ізомерія, спри¬чинена будовою карбонового скелета і положенням гідро¬ксильної групи.
• Пригадайте, що таке ізомерія. Напишіть формули ізомерів складу
С4Н10.
Міжнародні назви спиртів утворюють від назв відповідних вуглеводнів додаванням суфікса -ол. Щоб дати назву спирту, треба пронумерувати карбоновий ланцюг, починаючи від гідроксильної групи, перед назвою вказати місце і назву радикалу, після назви — місце гідроксильної групи.
Фізичні властивості метанолу й етанолу. Метанол і етанол за нормальних умов — рідини, легші за воду, мають специфічний запах, як полярні, сполуки, вони добре розчинні у воді метанолу дорівнює 65 °С, етанолу — 78 °С.
• Вода — полярний розчинник. Пригадайте розчинність неполярних насичених вуглеводнів, порівняйте її з розчинністю полярних спиртів. Зробіть висновок.
Метиловий спирт — дуже отруйна рідина, у разі потрапляння в організм 10 мл метанолу спричинюють сліпоту, а 25 мл — смерть.
Етиловий спирт за дією на організм є наркотиком, що в невеликих дозах спричинює сп'яніння, у великих — навіть смерть. Зловживання напо/ями, що містять етанол (інакше алкоголь), викликає страшне захворювання — алкоголізм.
Метанол і етанол — дуже подібні рідини, розрізнити їх можна лише хімічним способом або за температурою кипіння. Трапляються випадки, коли люди помилково вживають метанол замість етанолу, щ0 призводить до трагічних наслідків.
Хімічні властивості метанолу й етанолу. Спирти, як і всі
органічні сполуки, горять. Метанол і етанол миттєво спалахують при підпалюванні й горять синюватим, майже непомітним полум'ям із виділенням великої кількості теплоти. Відбувається реакція повного окиснення:
2СН3—ОН + 302-----> 2С02 + 4Н20; Дж= -715 кДж/моль
• Напишіть рівняння реакції горіння етанолу.
Завдяки тому, що електронна густина зв'язку О—Н зміщена до атома Оксигену, атом Гідрогену набуває більшої рухливості й легше відщеплюється. Під дією активних металів, таких як натрій, калій, магній, алюміній, відбувається заміщення атома Гідрогену на атом металу.
У пробірку з етиловим спиртом покладемо шматочки натрію. Одразу відбувається реакція з виділенням газу. Це водень.
• Пригадайте, як його можна виявити.
Етилат натрію
Якщо краплю розчину з пробірки перенести на скло і випарити, то на склі утворяться кристали етилату.
• Напишіть рівняння реакції метанолу з калієм. Назвіть продукт реакції.
Реакції спиртів можуть відбуватися і з відщепленням гідроксильної групи. Спирти взаємодіють з галогеноводнями. Наприклад, якщо сухий галогеноводень пропускати крізь спирт або нагрівати спирт з концентрованим розчином хлоридної кислоти, відбувається реакція заміщення гідроксильної групи на галоген.
Хлоретан
• Напишіть рівняння реакції метанолу з бромоводнем. Назвіть продукт реакції.
Якщо етанол нагрівати вище 170 °С за наявності концентрованої сульфатної кислоти, відбувається реакція дегідратації (відщеплення води), спирт перетворюється на ненасичений вуглеводень етилен.
Про деякі інші властивості спиртів ви дізнаєтеся далі.
Як ви могли переконатися, властивості (функції) спиртів визначаються наявністю гідроксильної групи. Така група називається функціональною. У молекулах органічних сполук можуть міститись одна або кілька різних чи однакових функціональних груп.
Застосування метанолу й етанолу. Метиловий спирт був уперше добутий у XVII ст., а вивчений у першій половині XIX ст. Його називають ще деревним спиртом за першим із відомих методів добування, а саме шляхом сухої перегонки деревини.
Етиловий спирт, етанол, винний спирт, алкоголь — назви-синоніми однієї сполуки, що є основою алкогольних напоїв і найвідоміша із класу спиртів. Археологічні розкопки засвідчують, що в епоху найдавніших цивілізацій уміли виробляти вино й пиво. Скидається на те, що алкоголь був найпершою сполукою, синтезованою людиною. Перша літературна згадка про власне етиловий спирт як «горючу воду», добуту перегонкою вина, відноситься до VIII ст., а елементний склад етанолу було з'ясовано на початку ХІХ ст.
Метанол і етанол — розчинники. Ця їхня властивість використовується в органічному синтезі та лабораторній практиці. Етанол як розчинник застосовується у фармації, медицині (екстрагування, виготовлення настоянок тощо), харчовій промисловості.
За допомогою хімічних перетворень із цих спиртів добувають речовини, що є вихідними для виробництва пластмас і каучуку.
Етанол використовується для синтезу оцтової кислоти, у суміші з бензином — як пальне.
Завдання для самоконтролю
1. Які сполуки називаються спиртами?
2. Що таке функціональна група?
3. Чим зумовлена ізомерія спиртів?
4. Серед наведених формул знайдіть формули ізомерів і гомологів:
(1) СН3—СН—СН2—СН3 (2) СН3—СН,—СН2—СН2—ОН
ОН
(3) СН3—ОН (4) СН2—СН2—СН2—СН2
СН3 ОН
До яких сполук належать спирти — до хімічно активних чи інертних? Чим визначається їхня поведінка? Поясніть на основі електронних уявлень.
6. У результаті добування етилату натрію масою 68 г виділився водень (н. у.) об'ємом
(1) 22,4 л; (2) 11,2 л; (3) 44,8 л; (4) 5,6 л.
(Ш Напишіть рівняння послідовного перетворення етанолу на
Як трьома/способами добути хлоретан? Напишіть рівняння
ГЛІЦЕРИН
Склад і будова молекули гліцерину. Крім одноатомних спиртів, тобто тих, що містять у молекулі одну функціональну групу, існують багатоатомні спирти, до скла,ду_яких входять двіібільше гідроксильні групи. До них належить гліцерин — трьохатомний спирт. Структурна формула гліцерину
Н-С-С-С-Н, або скорочено СН2—СН-СН2 III
ОН ОН ОН ОН ОН ОН
Фізичні властивості гліцерину. Це густа сиропоподібна рідина без запаху і кольору, солодка на смак, добре розчинна у воді. Властивості гліцерину відображає його назва «олійний цукор», вживана у^УПІ ст., коли гліцерин було добуто вперше з маслинової
Лабораторна робота
Досліди з гліцерином
Дослід 1. РОЗЧИННІСТЬ гліцерину у воді. Змішайте у пробірці воду і гліцерин (приблизно по 1 мл). Додайте до суміші ще 1 мл гліцерину. Чи розчиняється він? Зробіть висновок про розчинність гліцерину у воді.
14
Хімічні властивості гліцерину.
Наявність гідроксильних груп зумов-лює подібність гліцерину до одноатомних спиртів, він вступає в ті самі оеакції, але за участю трьох гідро-ксильних груп.
Реакція повного окиснення (горіння) відбувається, як і в інших ор ганічнйх речовин, з утворенням вуг
лекислого газу і води.
Складіть рівняння реакції горіння гліцерину.
Модель молекули гліцерину
Гліцерин вступає в реакцію заміщення з металічним натрієм. У пробірку з гліцерином опустимо шматочок натрію, нагріємо. Реакція відбувається з виділенням водню.
У реакціях з галогеноводнями відбувається заміщення гідроксильних груп гліцерину на галоген.
Характерною реакцією гліцерину є утворення розчину синього кольору з гідроксидом купруму(П).
Дослід 2. Взаємодія гліцерину з гідроксидом купруму(ІІ). У пробірку налийте 1 мл розчину гідроксиду натрію чи калію і додайте кілька крапель розчину сульфату купруму(ІІ). Спостерігайте утворення осаду гідроксиду купруму(ІІ). До осаду додайте гліцерин, суміш збовтайте. Спостерігайте утворення прозорого розчину синього кольору.
Продукт реакції має складну хімічну будову, тому ми не записуємо рівняння реакції.
Ця хімічна спроба слугує для виявлення багатоатомних спиртів.
Застосування гліцерину. Гліцерин — продукт, що має широке застосування. Завдяки гігроскопічності він використовується в парфумерії та фармації як зм'якшувальний засіб або основа мазей, добавка до мила, у харчовій промисловості — як добавка до напоїв. У шкіряному виробництві та текстильній промисловості — для обробки пряжі і шкіри з метою їх пом'якшення та надання еластичності. З гліцерину добувають вибухову речовину нітрогліцерин, що використовується для виготовлення динаміту Спиртовий розчин нітрогліцерину має судинорозширювальну дію й у вигляді ліків використовується при серцевих захворюваннях.
Завдання для самоконтролю
9. До якого класу сполук належить гліцерин? Чому?
10. Порівняйте склад і властивості етанолу й гліцерину. Чим зумовлена відмінність між цими сполуками?
11. Якщо в реакцію з гліцерином вступає натрій масою 69 г. виділяється водень об'ємом (н. у.)
(1) 22.4 л; (2) 44.8 л; (3) 33.6 л; (4) 11.2 л.
12. У двох пробірках містяться етанол і гліцерин. Як хімічним шляхом розрізнити ці рідини?
13. Двохатомний спирт етиленгліколь має формулу СЩ—СН2
ОН ОН і подібний за властивостями до гліцерину. Напишіть рівняння хімічних реакцій, що характеризують властивості етиленгліколю.
14. Чи відомий вам гліцерин із побутового застосування? Розкажіть про це.
15. Трускавецька мінеральна вода «Юзя» містить гліцерин. Здавна місцеві дівчата вмиваються нею «для краси». На яких власти-
востях, на вашу думку, заснована дія цієї води?
ФЕНОЛ
Склад і будова молекули фенолу. У разі, коли гідроксильна група сполучена безпосередньо з бензольним ядром, утворюється сполука фенол, представник класу фенолів. Молекулярна формула С6Н5—ОНу-структурна формула
Фенол — низькоплавна речовина
Фізичні властивості фенолу. Фенол — кристалічна речовина, безбарвна, має характерний запах. У разі зберігання в нещільно закритому посуді внаслідок окиснення набуває рожевого кольору (ТПЛ>42°С).
Помістимо пробірку з фенолом у посудину з гарячою водою: речовина розплавиться.
У холодній воді фенол розчиняється погано. Але якщо додати у пробірку з фенолом гарячої води, спостерігатиметься його швидке розчинення.
Хімічні властивості фенолу. За наявністю в молекулі фенолу гідроксильної групи можна припустити подібність між фенолом і спиртами, а за наявністю бен-
Модель молекули фенолу
• Пригадайте, як взаємодіє етанол з металічним натрієм. Складіть рівняння реакції.
Нагріємо фенол у пробірці до плавлення і помістимо в нього шматочки металічного натрію. Спостерігається виділення водню, утворюється також фенолят натрію в результаті реакції заміщення гідроксильного Гідрогену на Натрій;
Фенолят натрію
Отже, фенол реагує з натрієм так само, як спирти. Проте наявність у молекулі бензольного ядра зумовлює відмінність у хімічній поведінці фенолу і спиртів.
Наприклад, етанол не реагує з розчином лугу, а фенол вступає в цю реакцію, утворюючи фенолят:
Фенолят натрію
У цій реакції фенол поводить себе як кислота, що нейтралізує луг, утворюючи сіль і воду. Зважаючи на кислотні властивості фенолу, його називають ще карболовою кислотою, хоч це дуже слабка кислота.
Ми розглянули реакції фенолу за гідроксильною групою. Тепер розглянемо реакції за бензольним ядром.
Ви вже знаєте, що бензол не реагує з бромною водою. Якщо ж до розчину фенолу додати бромну воду, відбудеться реакція заміщення (бромування) з утворенням білого осаду трибромо-фенолу:
На прикладі реакцій фенолу ви ознайомилися з явищем взаємного впливу атомів у молекулі. Бензольне ядро так
впливає на гідроксильну групу, що полегшується відщеплення гідроксильного' Гідрогену і фенол виявляє кислотні властивості; гідроксильна група так впливає на бензольне ядро, що полегшується заміщення гідрогенових атомів ядра і фенол реагує з бромною водою.
Взаємний вплив атомів у молекулі має електронну природу і докладніше вивчається в повному курсі органічної хімії.
Характерною реакцією фенолу, за якою його можна виявити серед інших речовин, є реакція з розчином хлориду феру-му(Ш) Унаслідок зливання розчинів речовин утворюється сполука фіолетового кольору. її формула не наводиться через складність будови.
Застосування фенолу. Фенол було вперше виділено з кам'яновугільної смоли в першій половині XIX ст. Його застосування тісно пов'язане з розвитком синтетичної органічної хімії. Фенол є вихідною речовиною для виробництва барвників, лікувальних препаратів, пластичних мас, вибухових речовин.
Фенол має антисептичні властивості, які були виявлені ще у другій половині XIX ст. Вони зумовлюють використання його розчину (5%-го) для знезаражування приміщень, хірургічних інструментів, його добавляють до деяких сортів мила, ним протравлюють деревину, щоб запобігти її гниттю.
Разом з тим це токсична речовина, що може спричинити опіки шкіри. Оскільки фенол є продуктом коксохімічної промисловості, то вкупі з іншими промисловими викидами він потрапляє у стічні води, тим самим забруднює навколишнє середовище.
Завдання для самоконтролю
1 Схарактеризуйте подібні хімічні властивості фенолу й одноатомних спиртів.
2. Яка особливість хімічної будови фенолу зумовлює йото відмінність від представників класу спиртів?
3. До якого типу реакцій належить реакція фенолу з лугом?
4. У трьох пробірках містяться етанол, гліцерин, розчин фенолу. Як розрізнити вміст пробірок за фізичними і хімічними власти- ,
востями цих сполук.
5. У чому полягає вплив гідроксильної групи на власт
ивості
фенолу порівняно з бензолом?
6. До розчину феноляту натрію обережно краплями додають сульфатн>' кислоту. Розчин каламутніє. Чому? Складіть рівняння реакції.
7*. Речовина, що має будову НО тиме в реакції:
(1) з натрієм і з гідроксидом натрію;
(2) тільки з натрієм;
(3) тільки з гідроксидом натрію.
Альдегіди
Склад і будова молекул альдегідів. До класу альдегідів належать речовини, у молекулах яких функціональна альде-
гідна група —с сполучена з вуглеводневим радикалом (у
^Н найпростішої з цих речовин — з атомом Гідрогену). Загальна формула альдегідів
С„Н2п+1СНО, або К— СНО
Порівняно зі спиртами у складі молекул альдегідів на два атоми Гідрогену менше. Це відбивається у назві «альдегіди», що походить від слів «алкоголь» і «дегідрування», тобто де-гідрований алкоголь.
Назва першого члена гомологічного ряду — метаналь, або формальдегід, або мурашиний альдегід.
Наступний у гомологічному ряду — етаналь, або ацет-альдегід, або оцтовий альдегід.
Традиційні назви альдегідів походять від назв кислот, на які ці альдегіди перетворюються в результаті окиснення (у наведених прикладах — від мурашиної та оцтової кислот).
Міжнародні назви альдегідів утворюють від відомих вам назв вуглеводнів з додаванням суфікса -аль. Отже, наступний у гомологічному ряду — пропаналь
СНз СН2—Сч
Фізичні властивості ацетальдегіду. Це
летка безбарвна рідина, добре розчинна у воді, має різкий характерний запах.
Хімічні властивості ацетальдегіду. Подвійний зв'язок між атомами Карбону й Окси-гену в альдегідній групі поляризований за рахунок відтягування електронів до атома Окси-гену як більш електронегативного елемента. На ньому виникає частковий негативний заряд, а на атомі Карбону — частковий позитивний заряд:
Мал. 4. Модель молекули ацетальдегіду
Саме це визначає хімічну активність альдегідів. Вони легко вступають у реакції окиснення.
Часткове окиснення ацетальдегіду можна провести за допомогою гідроксиду купруму(И). До свіжоприготовленого осаду гідроксиду купруму(И), добутого внаслідок зливання розчинів сульфату купруму(И) і гідроксиду натрію, додамо розчин ацетальдегіду, нагріємо суміш. У пробірці утворюється жовтий осад гідроксиду купруму(І), що швидко розкладається на оксид купруму(І) червоного кольору і воду:
СН3—С + 2Си(ОН)2-----> СН3—С ч- 2СиОН + Н20
Оцтова кислота
2СиОН-----> Си20 + Н20
Окиснити ацетальдегід можна й іншим реактивом — аміачним розчином оксиду аргентуму(І). Внаслідок нагрівання у ретельно вимитій колбі суміші цього реактиву з оцтовим альдегідом на стінках посуду випадає осад металічного срібла, що вкриває стінки блискучим шаром. Через це реакція зветься реакцією «срібного дзеркала».
Наведені реакції характерні для альдегідів і використовуються з метою їх аналітичного визначення.
Зважаючи на те, що альдегідна група містить подвійний зв'язок, можна припустити, що альдегід вступатиме в реакцію приєднання за місцем цього зв'язку.
Для якої групи органічних речовин характерні реакції приєднання? Наведіть рівняння реакції гідрування.
Приєднуючи водень, ацетальдегід перетворюється на етиловий спирт:
сн3—с +н2 —> сн3—сн2—он
Етиловий спирт
Таким чином можна відновити альдегід до спирту. З іншого боку, спирт можна окиснити до альдегіду.
Лабораторна робота 2
Окиснення спирту до альдегіду
Мідну дротину розжарте в полум'ї спиртівки. Коли вона вкриється мідною окалиною (СиО), опустіть ЇЇ в пробірку з етиловим спиртом. Відчувається характерний запах оцтового альдегіду.
Зверніть увагу на колір мідної дротини — окалина відновлюється до металічної міді. Реакція відбувається за рівнянням:
СН3—СН2—ОН + СиО —-> СН3—С + Н20 + Си
ЕТИЛОВИЙ спирт
Оцтовий альдегід
• Доповніть свої записи в темі «Спирти» інформацією про властивість спиртів окиснюватись до альдегідів. Запишіть рівняння реакції.
Розглянуті реакції окиснення і відновлення важливі для здійснення взаємних перетворень речовин різних класів.
Застосування оцтового альдегіду. Реакції окиснення зумовлюють застосування цієї сполуки для добування оцтової кислоти.
У невеликих кількостях оцтовий альдегід утворюється під час обміну речовин в організмі людини, зокрема в результаті метаболізму алкоголю. Надлишок ацетальдегіду шкідливий і викликає неприємні відчуття, що використовується з метою лікування алкоголізму.
Вислано читачаму з сайту
Плани уроків хімії, підручники онлайн, електронні видання безкоштовно, навчальна програма, скачати тести безкоштовно, календарне планування уроків хімії, готові домашні завдання
 акселеративні методи на уроці акселеративні методи на уроці  національні особливості національні особливості
 виділити головне в уроці - опорний каркас виділити головне в уроці - опорний каркас  нічого собі уроки нічого собі уроки
 відеокліпи відеокліпи  нова система освіти нова система освіти
 вправи на пошук інформації вправи на пошук інформації  підручники основні допоміжні підручники основні допоміжні
 гумор, притчі, приколи, приказки, цитати гумор, притчі, приколи, приказки, цитати  презентація уроку презентація уроку
 додаткові доповнення додаткові доповнення  реферати реферати
 домашнє завдання домашнє завдання  речовки та вікторизми речовки та вікторизми
 задачі та вправи (рішення та відповіді) задачі та вправи (рішення та відповіді)  риторичні питання від учнів риторичні питання від учнів
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)  рівень складності звичайний І рівень складності звичайний І
 знайди інформацію сам знайди інформацію сам  рівень складності високий ІІ рівень складності високий ІІ
 ідеальні уроки ідеальні уроки  рівень складності олімпійський III рівень складності олімпійський III
 ілюстрації, графіки, таблиці ілюстрації, графіки, таблиці  самоперевірка самоперевірка
 інтерактивні технології інтерактивні технології  система оцінювання система оцінювання
 календарний план на рік календарний план на рік  скласти пазл з різних частин інформації скласти пазл з різних частин інформації
 кейси та практикуми кейси та практикуми  словник термінів словник термінів
 комікси комікси  статті статті
 коментарі та обговорення коментарі та обговорення  тематичні свята тематичні свята
 конспект уроку конспект уроку  тести тести
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|














