|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас. Повні уроки>>Хімія: Фізичні властивості основ. Класифікація основ. Хімічні властивості основ: дія на індикатори, взаємодія з кислотами, кислотними оксидами, солями. Реакція нейтралізації. Розкладання нерозчинних основ під час нагрiвання. Заходи безпеки під час роботи з лугами. Використання основ. Повні уроки
Тема
Мета уроку
Задачі уроку
Основні терміни
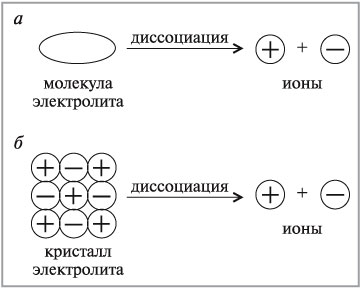
Хід урокуФізичні властивості основОснови – це сполуки, при розчиненні яких збільшується концентрація негативно заряджених іонів розчинника. З точки зору теорії електролітичної дисоціації основи – електроліти, які у водному розчині дисоціюють з утворенням лише одного типу аніонів – гідроксид іонів. Докладніше про електроліти ви можете дізнатися з наступного відео. Відео 1. Електроліти.
Мал. 1. Дисоціація електроліта. При звичайних умовах усі основи є твердими речовинами. Мал. 2. Властивості розчинних і нерозчинних основ. Розчинні основи, або луги, білого кольору. Зазвичай вони милкі на дотик, їдкі, тому треба уникати їх попадання на шкіру, бо вони роз’їдають її, так як і шкіру, і папір. Тобто, при роботі з ними треба дотримуватися певних норм безпеки, для уникнення можливого отримання травм. тверді речовини білого кольору, милкі на дотик, їдкі, роз’їдають шкіру, тканини, папір. Нерозчинні основи, які всі основи є твердими речовинами, але, на відміну від лугів, можуть бути різноманітними за забарвленням. Контролюючий блок 1
Класифікація основОсновами називаються сполуки, негативно зарядженою частиною яких є гідроксид-іони ОН-. До складу основ входять іон металу (або група атомів NH4, TiO2, VO2, BiO, [Cu(NH3)4]2, що відіграє роль металу) та гідроксид-іони, кількість яких дорівнює валентності металу. Загальна формула основ Ме(ОН)х. Приклади основ: LiOH, Ba(OH)2, Bi(OH)3, Mn(OH)2, Fe(OH)2, Co(OH)3, [Cu(NH3)4](OH)2 тощо. Кількість гідроксид-іонів в основі, що здатні заміщуватись на кислотні залишки з утворенням солей, визначає її кислотність. Тому основи можуть бути одно кислотні (NaOH, NH4OH), двокислотні (Ba(OH)2, Fe(OH)2), три кислотні (Bi(OH)3, La(OH)3, Mn(OH)3), чотири кислотні (Th(OH)4). Через те що із збільшенням ступеня окислення елемента основні властивості його оксиду послаблюються, відома невелика кількість чотири кислотних основ, а п’ятикислотні і шестикислотні невідомі. Контролюючий блок 2
Хімічні властивості основ (взаємодія з різними неорганічними сполуками). Реакції нейтралізаціїВсі основи можна поділити на розчинні і нерозчинні у воді. Розчинними є основи, утворені лужними, лужно-земельними металами, амонієм, талієм (І), складними групами атомів [Cu(NH3)4]2 тощо. Розчини лугів розїдають тваринні, рослинні тканини, викликають зміну забарвлення індикаторів. Як добуваються нерозчинні основи ви можете дізнатися з наступного відео. Відео 2. Добування нерозчинних основ.
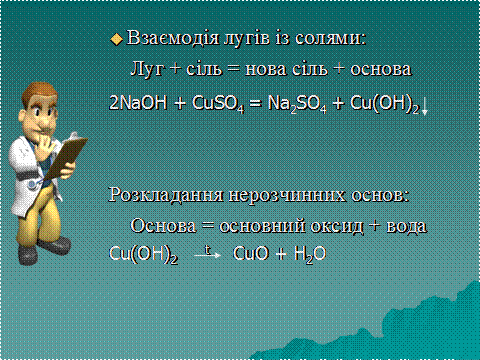
Основи взаємодіють з кислотами, кислотними й амфотерними оксидами та гідроксидами, солями: Хімічні властивості нерозчинних основ: Мал. 6. Розкладання нерозчинних основ та взаємодія лугів з солями. Щоб наглядно зрозуміти хімічні властивості нерозчинних основ, пропонуємо вам переглянути наступне відео. Відео 3. Хімічні властивості нерозчинних основ.
Контролюючий блок 31. Які основи є розчинними і як вони називаються? Домашнє завданняНапишіть хімічні реакції за наступними даними: Цікаво знати, що…Цікаво спостерігати за таємничою поведінкою іскри, яка пише на «чистому» аркуші паперу. Виконайте таку спробу. НА аркуші не проклеєного паперу (фільтрувальний папір для цього непридатний) зробіть концентрованим розчином калій нітрату за допомогою гусячого пера зигзагоподібну лінію (яка не перетинається). Початок лінії відмітьте олівцем (крапкою). Дайте паперу просохнути. Доторкніться до крапки на папері розпеченою дротинкою або вуглецем. По паперу починає поволі просуватись ледве жевріючий вогник, який слухняно виписує зроблену перед цим калій-нітратом лінію. Це явище пояснюється так. При нагріванні калій нітрату відбувається реакція: Папірець у місці розкладу солі звуглюється. За рахунок тепла згоряння паперу розкладаються на все нові та нові частиниKNO3, і вогник «повзе» по папірцю. «Слухняний» вогонь-художник нарисує (або напише) все, що вам потрібно. Список використаних джерел1. Урок на тему «Основи та їх місце у нашому житті» Князєвої М. В., вчителя хімії, м. Бєлгород, СШ №39.
Князєва М.В. Сискова Р.Ф. Лісняк А.В.
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: