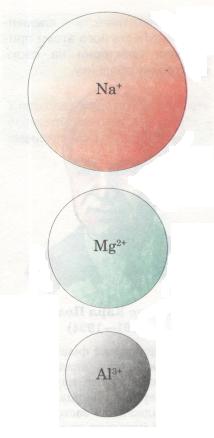|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Будова електронних оболонок атомів хiмічних елементів. Поняття про радіус атома
БУДОВА ЕЛЕКТРОННОЇ ОБОЛОНКИ АТОМА
Ти вже знаєш, що атом складається з ядра й електронів, які утворюють електронну оболонку атома. Число електронів на оболонці дорівнює числу протонів у ядрі атома і визначається протонним числом елемента (порядковим номером). Аби зрозуміти, як побудована електронна оболонка атома, потрібно з'ясувати, як розподіляється електронна густина біля ядра, тобто визначити ділянку простору, де можуть перебувати електрони даного атома.
Число електронів на оболонці дорівнює числу протонів у ядрі атома і визначається протонним числом елемента
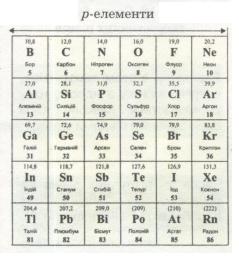
Мал. 12. р-елементи.
Електрони в атомі розмішуються на різній відстані від ядра. Це пояснюється тим, що електрони мають різний запас енергії. Одні з них сильніше притягуються до ядра і розмішуються ближче до нього, вони міцніше зв'язані з ядром і їх важче вирвати з електронної оболонки. Інші — слабкіше притягуються і перебувають далі від ядра. А чим далі електрони від ядер, тим легше їх відірвати. Виходить, що в міру віддалення від ядра
атома запас енергії електрона збільшується (мал. 13).
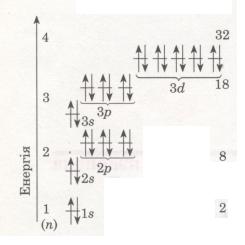
Мал. 13. Схема будови енергетичних рівнів
Електрони, що рухаються поблизу ядра, заслоняють (екранують) ядро від інших електронів, які притягуються до нього слабкіше і рухаються на більшій відстані від ядра. Так утворюються електронні шари в електронній оболонці атома. Кожний електронний шар складається з електронів з близькими значеннями енергії, тому електронні шари називають ще енергетичними рівнями.
Число енергетичних рівнів дорівнює номеру періоду, в якому перебуває хімічний елемент. Отже, електронна оболонка атомів елементів першого періоду містить один енергетичний рівень, другого періоду — два, третього — три і т. д.
Кожний енергетичний рівень складається з орбіталей певної форми: перший містить одну s-орбіталь, другий — s- і р-орбіталі, третій — s-, р-, d-орбіталі. Отже, зверни увагу: який номер рівня, стільки й форм орбіталей, що його утворюють.
Число орбіталей на енергетичних рівнях різне, воно дорівнює n2, де n — номер рівня. На першому рівні (n = 1) одна 8-орбіталь, на другому (n = 2) — чотири: одна s- і три р-орбіталі, на третьому (n = 3) — дев'ять: одна три р- і п'ять d-орбіталей (див. мал. 13). Зважаючи на те, що на кожній з орбіталей може перебувати не більше двох електронів, максимальна кількість електронів на тому чи іншому енергетичному рівні дорівнює 2n2 (див. мал. 13).
Число ж електронів на зовнішньому енергетичному рівні електронної оболонки атома дорівнює номеру групи для хімічних елементів головних підгруп. Ці електрони називаються валентними. Саме вони визначають властивості елемента.
Тепер розглянемо конкретні приклади. Атом Гідрогену має найменший заряд ядра (+1), отже, й один електрон. Він розмішується на єдиній s-орбіталі, утворюючи перший енергетичний рівень (див. мал. 13). Таке уявлення можна передати за допомогою схеми
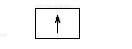
і за допомогою електронної формули 1s1, де

За Гідрогеном іде Гелій. Його атом містить ядро із зарядом +2, біля якого рухаються два електрони на тому самому першому енергетичному рівні:

Оскільки на першому енергетичному рівні може перебувати тільки два електрони, то в атомі Гелію перший рівень є завершеним.
В елементів другого періоду починає формуватися другий енергетичний рівень, на якому може перебувати не більше 8 електронів (див. мал. 13).
Спробуй самостійно записати електронні формули елементів другого періоду і покажи розподіл електронів за енергетичними комірками. Ось що виходить:
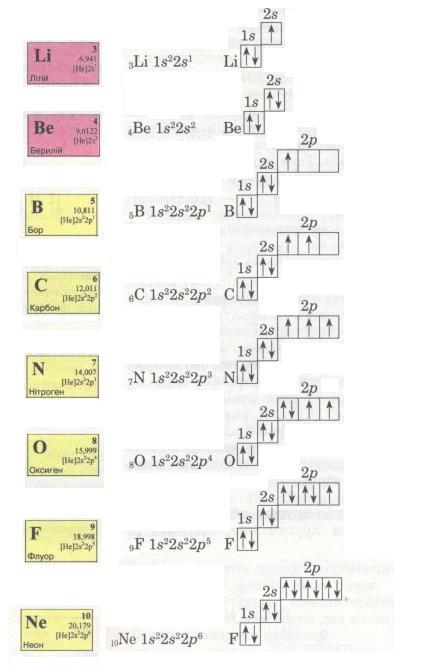
Мал. 14. Електронні формули.
Електрони заповнюють енергетичні рівні в порядку послаблення притягання їх до ядра: спочатку s-, потім р-орбіталі, далі по одному, а якщо їх більше за число орбіталей, то по два, утворюючи електронні пари з протилежними спінами
Оскільки на зовнішньому енергетичному рівні не може бути більше 8 електронів, то в атомі Неону другий рівень є завершеним.
В електронній оболонці атомів елементів третього періоду починає формуватися третій енергетичний рівень. Згідно з формулою 2n2 на ньому може бути максимально 18 електронів (див. мал. 13), але повністю забудуватися він не встигає (чому?).
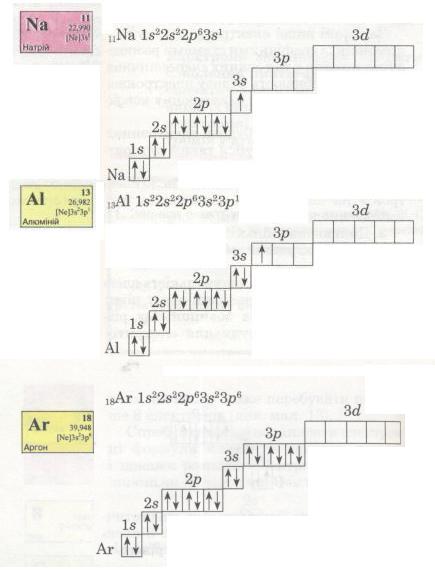
Мал. 15. Електронні формули.
В атомі Аргону зовнішній енергетичний рівень містить 8 електронів, отже, він завершений. Проте забудова третього рівня цим не вичерпується, бо він може містити загалом 18 електронів, тобто ще 10 електронів на d-підрівні. Цей підрі-вень формуватиметься далі, у наступному періоді (вивчатиметься пізніше).
Записані вище електронні формули у поєднанні з графічними схемами розподілу електронів у так званих енергетичних комірках відбивають будову електронної І оболонки атома, його електронну конфігурацію.
Складаючи схеми будови електронних оболонок атомів, керуйся таким алгоритмом:
1. Спершу визнач загальне число електронів на електронній оболонці за протонним числом елемента.
2. Далі визнач кількість енергетичних рівнів у електронній оболонці за номером періоду.
3. Визнач максимальну кількість електронів на кожному енергетичному рівні за формулою 2n2 (на зовнішньому рівні — за номером групи для елементів головних підгруп).
4. Пригадай, що кількість форм орбіталей, які утворюють даний енергетичний рівень, дорівнює номеру цього рівня.
5. Не забудь, що на кожній орбіталі може перебувати максимум два електрони (з протилежними спінами).
ВИСНОВКИ
Електрони в атомі мають різну енергію зв'язку з ядром: чим вона більша, тим ближче до ядра розміщується електрон. У результаті електрони в атомі розподіляються шарами, на різних енергетичних рівнях. Максимальна кількість електронів на даному рівні дорівнює 2n2: на першому рівні може бути тільки два електрони, на другому — вісім. Такі рівні є завершеними.
Число енергетичних рівнів дорівнює номеру періоду, в якому перебуває елемент.
Число електронів на зовнішньому рівні атома хімічного елемента дорівнює номеру групи (для елементів головних підгруп).
Електрони заповнюють енергетичні рівні в порядку послаблення притягання їх до ядра (від 1-го до наступних): спочатку s-орбіталі, потім р-орбіталі, далі по одному, а якщо їх більше за число орбіталей — то по два, утворюючи електронні пари з протилежними спінами. Розподіл електронів у атомі по орбіталях показує електронна формула.
Завдання для самоконтролю
1. Запиши електронні формули атомів Mg, Si, СІ і графічно зобрази розміщення електронів за енергетичними комірками.
2. Максимальне число електронів, які можуть займати Зв-підрівень, дорівнює
(а) 1; (б) 2; (в) 6; (г) 8.
3. На зовнішньому енергетичному рівні атома Сульфуру міститься електронів
(а) 2; (б) 4; (в) 6; (г) 8.
4. Скільки завершених енергетичних рівнів міститься в атомах хімічних елементів із протонними числами: а) 4; б) 10; в) 17? Відповідь поясни.
5. Число протонів у ядрі атома Феруму дорівнює (а) 2; (б) 8; (в) 26; (г) 56.
6. Заповнення електронами р-підрівня відбувається в атомі (а) Калію; (б) Сульфуру; (в) Гелію; (г) Алюмінію.
7. Число електронів на зовнішньому електронному р-підрівні атома Хлору дорівнює
(а) 7; (б) 3; (в) 5; (г) 6.
8. Елемент, атом якого має конфігурацію 1s22s2p63s23p1 — це (а) Аl; (б) Са; (в) СІ; (г) Na.
Додаткові завдання
9. Запиши електронну конфігурацію атома Калію.
10. Електронна конфігурація 1s22s22p63s23p64s2 відповідає атому
(а) Кальцію; (6) Калію; (в) Скандію; (г) Аргону.
Склади схему розподілу електронів даного атома за енергетичними комірками.
11*. Електронну конфігурацію атома інертного газу має
(а) Те2-; (б)Сu+; (в) Fe2+; (г)Сr3+.
12*. Число електронів у йоні Хрому 5224Сr3+ дорівнює
(а) 21; (6) 24; (в) 27; (г) 52.
13*. Частинки Ne0, Na+, F- мають однакове
(а) нуклонне число; (в) число електронів;
(б) число нейтронів; (г) протонне число.
14*. Скорочена електронна конфігурація основного стану ...3d54s24p0 відповідає атому із зарядом ядра
(а) 20; (б) 25; (в) 30; (г) 35.
15*. Серед наведених позначень електронних конфігурацій неможливими є
(а)1р1; (б)1s2; (в) 2d4; (г) 3f2.
Відповідь мотивуй.
16*. Одну вільну р-орбіталь має на зовнішньому електронному рівні атом
(а) Берилію; (б) Алюмінію; (в) Карбону; (г) Скандію.
ПОНЯТТЯ ПРО РАДІУС АТОМА
Тобі вже відомо, що в періодах у міру зростання заряду ядра атомів елементів послідовно змінюється структура зовнішнього енергетичного рівня (кількість валентних електронів). Саме з цим пов'язана зміна властивостей елементів, тобто тих ознак, які становлять їх відмінну особливість. Такими ознаками можуть бути радіус атома, електронегативність, металічний або неметалічний характер елемента та його сполук тощо.
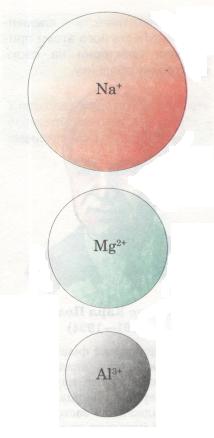
Мал. 16. Порівняльний розмір йонів
Радіус атома. У періодах із зростанням зарядів ядер атомів елементів притягання ядром електронної оболонки посилюється — відбувається своєрідне «стискання» їх, і радіус атомів і йонів зменшується (мал. 14). Наприклад, у разі переходу від Літію до Неону заряд ядра поступово збільшується (від +3 до +10), що зумовлює зростання сил притягання електронів до ядра. Розміри атомів при цьому зменшуються. Тому на початку періодів розміщуються елементи, в яких невелике число валентних електронів (на зовнішньому енергетичному рівні) і великий радіус атома. А в групах навпаки: зі збільшенням кількості енергетичних рівнів радіус атома збільшується.
У періодах із зростанням протонного числа радіус атомів елементів зменшується, а в групах (головних підгрупах) — збільшується.
Зрозуміло, чим більший радіус атома, тим далі від ядра перебувають валентні електрони і тим слабкіше вони зв'язані з ядром, отже, легше від нього відриваються. Така структура атома характерна для елементів-металів.
• Схарактеризуй електронну будову атомів елементів, розміщених у періодичній системі на- І прикінці періодів, наприклад 2-го чи 3-го. До яких родин елементів вони мають належати?
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту
Уроки хімії, календарно-тематичне планування з хімії 8 клас, допомога школяру
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|