|
|
|
| Строка 1: |
Строка 1: |
| - | <metakeywords>Гипермаркет Знаний - первый в мире!, Гипермаркет Знаний, Физика, 7 класс, Строение вещества, Атомы, молекулы</metakeywords> | + | <metakeywords>Гипермаркет Знаний - первый в мире!, Гипермаркет Знаний, Физика, 7 класс, Строение вещества, Атомы, молекулы, вещества, молекул, физической величиной, атомов, простых веществ, опытом, ядро, отрицательный заряд</metakeywords> |
| | | | |
| | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Физика и астрономия|Физика]]>>[[Физика 7 класс|Физика 7 класс]]>> Строение вещества. Атомы и молекулы''' | | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Физика и астрономия|Физика]]>>[[Физика 7 класс|Физика 7 класс]]>> Строение вещества. Атомы и молекулы''' |
| Строка 5: |
Строка 5: |
| | <br> | | <br> |
| | | | |
| - | *''Из чего состоят вещества? Насколько малыми являются наименьшие частички вещества? Существует ли отличие между молекулами одного и того же вещества? Можно ли сосчитать молекулы в булавочной головке? Эти и другие вопросы мы обсудим подробнее и вместе найдем ответы.'' | + | *''Из чего состоят [[Фізичне тіло і речовина. Маса тіла. Одиниці маси. Вимірювання маси тіл|вещества]]? Насколько малыми являются наименьшие частички вещества? Существует ли отличие между молекулами одного и того же вещества? Можно ли сосчитать молекулы в булавочной головке? Эти и другие вопросы мы обсудим подробнее и вместе найдем ответы.'' |
| | | | |
| - | <br>'''1. Различаем атом и молекулу''' | + | <br>'''1. Различаем атом и молекулу''' |
| | | | |
| - | Из предыдущего курса «Природоведение» вы уже знаете, что все вещества состоят из мелких частичек — молекул и атомов. Вы также знаете, что первичные составные части вещества — атомы — имеют специальные названия и символы для обозначения каждого из видов атомов. Например: водород (H), ртуть (Hg), кислород (О), углерод (С). Атомы разных видов отличаются друг от друга по своим химическим свойствам и массе. С физической величиной под названием «масса» вы уже познакомились в § 9. Что такое «химические свойства», вы узнаете из курса химии. | + | Из предыдущего курса «Природоведение» вы уже знаете, что все вещества состоят из мелких частичек — [[Масса молекул. Количество вещества|молекул]] и атомов. Вы также знаете, что первичные составные части вещества — атомы — имеют специальные названия и символы для обозначения каждого из видов атомов. Например: водород (H), ртуть (Hg), кислород (О), углерод (С). Атомы разных видов отличаются друг от друга по своим химическим свойствам и массе. С [[Физические величины и их измерение. Полные уроки|физической величиной]] под названием «масса» вы уже познакомились в § 9. Что такое «химические свойства», вы узнаете из курса химии. |
| | | | |
| - | По положению на 2005 год науке известны только 116 различных видов атомов. «He может быть,— возразите вы.— Как это, только 116? Каждый из нас с легкостью перечислит 200—300, а может быть, и больше различных веществ». Да, действительно, в мире существуют миллионы разных веществ. Как же соединить существование только 116 различных видов атомов с миллионами разных веществ? Дело в том, что вещества по большей части состоят из молекул. | + | По положению на 2005 год науке известны только 116 различных видов атомов. «He может быть,— возразите вы.— Как это, только 116? Каждый из нас с легкостью перечислит 200—300, а может быть, и больше различных веществ». Да, действительно, в мире существуют миллионы разных веществ. Как же соединить существование только 116 различных видов [[Молекулы и атомы|атомов]] с миллионами разных веществ? Дело в том, что вещества по большей части состоят из молекул. |
| | | | |
| - | [[Image:6.10-26.jpg]] | + | [[Image:6.10-26.jpg|550px|Модели молекул некоторых веществ]] |
| | | | |
| - | ''Рис. 2.11. Модели молекул некоторых веществ: а — метана (CH<sub>4</sub>); б — серной кислоты (H<sub>2</sub>SO<sub>4</sub>); <br>в — воды (H<sub>2</sub>O). (Синие шарики — атомы водорода, красные — кислорода, зеленые — серы, желтые — углерода.)''<br><br>Молекулой называется наименьшая частичка вещества, имеющая его основные химические свойства и состоящая из атомов. | + | ''Рис. 2.11. Модели молекул некоторых веществ: а — метана (CH<sub>4</sub>); б — серной кислоты (H<sub>2</sub>SO<sub>4</sub>); в — воды (H<sub>2</sub>O). (Синие шарики — атомы водорода, красные — кислорода, зеленые — серы, желтые — углерода.)'' |
| | | | |
| - | Ситуация с разными веществами очень похожа на составление тысяч разных слов из «только» 32 различных букв алфавита. В этом сравнении каждая буква — это, так сказать, отдельный атом, а каждое слово соответствует молекуле, т.е. определенному веществу.
| + | Молекулой называется наименьшая частичка вещества, имеющая его основные химические свойства и состоящая из атомов. |
| | | | |
| - | На рис. 2.11, а вы видите схематическое изображение молекулы метана, состоящей из пяти атомов: четырех атомов водорода и одного атома углерода. Пользуясь нашей аналогией,— это слово из пяти букв. На рис. 2.11, б приведена схема более сложной молекулы серной кислоты, состоящей из семи атомов. Аналог этой молекулы — слово из семи букв. Из приведенных примеров понятно, что каждая новая молекула (новая комбинация атомов) соответствует новому веществу.
| + | Ситуация с разными веществами очень похожа на составление тысяч разных слов из «только» 32 различных букв алфавита. В этом сравнении каждая буква — это, так сказать, отдельный атом, а каждое слово соответствует молекуле, т.е. определенному [[Фізичне тіло і речовина. Маса тіла. Одиниці маси. Вимірювання маси тіл|веществу]]. |
| | | | |
| - | <br>'''2. Знакомимся с простыми и сложными веществами'''
| + | На рис. 2.11, а вы видите схематическое изображение молекулы метана, состоящей из пяти атомов: четырех атомов водорода и одного атома углерода. Пользуясь нашей аналогией,— это слово из пяти букв. На рис. 2.11, б приведена схема более сложной молекулы серной кислоты, состоящей из семи атомов. Аналог этой молекулы — слово из семи букв. Из приведенных примеров понятно, что каждая новая молекула (новая комбинация атомов) соответствует новому веществу. |
| | | | |
| - | Продолжим нашу аналогию сравнения веществ со словами. Вы, наверное, знаете, что рядом с обычными словами, состоящими из нескольких разных букв, мы иногда произносим и слова с использованием только одной <br>буквы (например, «я», «а-а...», «у-у-у...»)... Так же и с веществами. Некоторые из них состоят только из одного вида атомов (одного химического элемента) и потому называются простыми (см. рис. 2.12). Примерами таких веществ является углерод, железо и др.
| + | <br>'''2. Знакомимся с простыми и сложными веществами''' |
| | | | |
| - | Совершенно очевидно, что слов, состоящих из нескольких букв, намного больше, чем слов из одной буквы. Так же и с веществами. Чаще всего в повседневной жизни мы сталкиваемся с веществами, молекулы которых состоят из атомов нескольких различных видов. Эти вещества так и называются — сложные (см. рис. 2.11).
| + | Продолжим нашу аналогию сравнения веществ со словами. Вы, наверное, знаете, что рядом с обычными словами, состоящими из нескольких разных букв, мы иногда произносим и слова с использованием только одной буквы (например, «я», «а-а...», «у-у-у...»)... Так же и с веществами. Некоторые из них состоят только из одного вида атомов (одного химического элемента) и потому называются простыми (см. рис. 2.12). Примерами таких веществ является углерод, железо и др. |
| | | | |
| | + | Совершенно очевидно, что слов, состоящих из нескольких букв, намного больше, чем слов из одной буквы. Так же и с веществами. Чаще всего в повседневной жизни мы сталкиваемся с веществами, молекулы которых состоят из атомов нескольких различных видов. Эти вещества так и называются — сложные (см. рис. 2.11).<br> |
| | | | |
| | + | [[Image:6.10-27.jpg|550px|Модели молекул простых веществ]] |
| | | | |
| - | [[Image:6.10-27.jpg]]
| + | ''Рис. 2.12 Модели молекул [[Простые вещества — неметаллы|простых веществ]]: а — водорода (H<sub>2</sub>); б — кислорода (O<sub>2</sub>); в — озона (O<sub>3</sub>); г — азота (N<sub>2</sub>); д — железа (Fe)''<br><br>Напомним, что в научной литературе во избежание путаницы применяются разные названия для простых веществ и для химических элементов, из которых эти вещества состоят. Примеры названий простых веществ и соответствующих им химических элементов приведены в таблице. |
| - | | + | |
| - | ''Рис. 2.12 Модели молекул простых веществ: а — водорода (H<sub>2</sub>); б — кислорода (O<sub>2</sub>); в — озона (O<sub>3</sub>); г — азота (N<sub>2</sub>); д — железа (Fe)''<br><br>Напомним, что в научной литературе во избежание путаницы применяются разные названия для простых веществ и для химических элементов, из которых эти вещества состоят. Примеры названий простых веществ и соответствующих им химических элементов приведены в таблице. | + | |
| - | | + | |
| | | | |
| | + | <br> |
| | | | |
| - | {| width="669" height="208" cellspacing="1" cellpadding="1" border="1" | + | {| width="669" cellspacing="1" cellpadding="1" border="1" |
| | |- | | |- |
| - | | Название химического элемента | + | | Название химического элемента |
| - | | Символ химического элемента | + | | Символ химического элемента |
| | | Название соответствующего простого вещества | | | Название соответствующего простого вещества |
| | |- | | |- |
| - | | Аурум | + | | Аурум |
| - | | Au | + | | Au |
| | | Золото | | | Золото |
| | |- | | |- |
| - | | Гидроген | + | | Гидроген |
| - | | H | + | | H |
| | | Водород | | | Водород |
| | |- | | |- |
| - | | Карбон | + | | Карбон |
| - | | С | + | | С |
| | | Углерод | | | Углерод |
| | |- | | |- |
| - | | Купрум | + | | Купрум |
| - | | Cu | + | | Cu |
| | | Медь | | | Медь |
| | |- | | |- |
| - | | Нитроген | + | | Нитроген |
| - | | N | + | | N |
| | | Азот | | | Азот |
| | |- | | |- |
| - | | Оксиген | + | | Оксиген |
| - | | О | + | | О |
| | | Кислород | | | Кислород |
| | |- | | |- |
| - | | Силициум | + | | Силициум |
| - | | Si | + | | Si |
| | | Кремний | | | Кремний |
| | |- | | |- |
| - | | Феррум | + | | Феррум |
| - | | Fe | + | | Fe |
| | | Железо | | | Железо |
| | |} | | |} |
| | | | |
| - | <br>'''3. Убеждаемся в наличии промежутков между молекулами''' | + | <br>'''3. Убеждаемся в наличии промежутков между молекулами''' |
| | | | |
| - | После того как мы познакомились с наименьшими частичками вещества, давайте вспомним некоторые сведения о строении вещества. | + | После того как мы познакомились с наименьшими частичками вещества, давайте вспомним некоторые сведения о строении вещества. |
| | | | |
| - | В результате проведенных исследований ученые выяснили, что между молекулами (атомами) существуют промежутки. Этот вывод ученых можно легко подтвердить довольно простым опытом. Если смешать 100 мл <br>воды и 100 мл спирта, то объем смеси будет меньше, чем 200 мл. Дело в том, что при смешивании двух жидкостей молекулы воды попадают в промежутки между молекулами спирта. Приведенный опыт можно смоделировать, например, с помощью пшена и гороха (рис. 2.13). Наполните стакан до половины пшеном, а потом прибавьте столько же гороха. Вы получите двухслойную композицию и полностью заполненный стакан. Аккуратно перемешайте эту композицию, и вы увидите, что объем смеси будет меньшим, чем <br>исходный — часть пшена разместилась в пустотах между горошинами. | + | В результате проведенных исследований ученые выяснили, что между молекулами (атомами) существуют промежутки. Этот вывод ученых можно легко подтвердить довольно простым [[Наблюдения и опыты . Полные уроки|опытом]]. Если смешать 100 мл воды и 100 мл спирта, то объем смеси будет меньше, чем 200 мл. Дело в том, что при смешивании двух жидкостей молекулы воды попадают в промежутки между молекулами спирта. Приведенный опыт можно смоделировать, например, с помощью пшена и гороха (рис. 2.13). Наполните стакан до половины пшеном, а потом прибавьте столько же гороха. Вы получите двухслойную композицию и полностью заполненный стакан. Аккуратно перемешайте эту композицию, и вы увидите, что объем смеси будет меньшим, чем исходный — часть пшена разместилась в пустотах между горошинами. |
| | | | |
| - | <br>'''4. Пытаемся представить себе размеры атомов''' | + | <br>'''4. Пытаемся представить себе размеры атомов''' |
| | | | |
| - | Атомы очень малы. Выяснено, что размеры атомов приблизительно равны 10 10 г (0,0000000001 м). Чтобы представить, насколько мало значение этой величины, приведем такое сравнение: диаметр молекулы во столько же раз меньше диаметра яблока, во сколько раз диаметр яблока меньше диаметра Земли. | + | Атомы очень малы. Выяснено, что размеры атомов приблизительно равны 10 10 г (0,0000000001 м). Чтобы представить, насколько мало значение этой величины, приведем такое сравнение: диаметр молекулы во столько же раз меньше диаметра яблока, во сколько раз диаметр яблока меньше диаметра Земли. |
| | | | |
| - | О размерах атомов также можно судить из такого примера. Если бы все люди нашей планеты проводили всю жизнь, занимаясь только счетом, то все вместе они смогли бы сосчитать атомы только в одной булавочной головке. | + | О размерах атомов также можно судить из такого примера. Если бы все люди нашей планеты проводили всю жизнь, занимаясь только счетом, то все вместе они смогли бы сосчитать атомы только в одной булавочной головке. |
| | | | |
| - | <br>'''5. Вспоминаем строение атома''' | + | <br>'''5. Вспоминаем строение атома''' |
| | | | |
| - | Опыты показали, что атом имеет сложную структуру. Он представляет собой положительно заряженное ядро, окруженное облаком легких частичек — электронов, имеющих отрицательный заряд (рис. 2.14). Масса ядра незначительно отличается от массы атома. Масса же электронов в сравнении с ядром очень мала. | + | Опыты показали, что атом имеет сложную структуру. Он представляет собой положительно заряженное [[Атом і атомне ядро. Дослід Резерфорда. Ядерна модель атома|ядро]], окруженное облаком легких частичек — электронов, имеющих отрицательный заряд (рис. 2.14). Масса ядра незначительно отличается от массы атома. Масса же электронов в сравнении с ядром очень мала. |
| | | | |
| | + | <br> |
| | | | |
| | + | [[Image:6.10-28.jpg|180px|Моделирование явления]] |
| | | | |
| - | [[Image:6.10-28.jpg]]
| + | ''Рис. 2.13. Моделирование явления уменьшения объема в результате смешивания различных жидкостей. Если взять горох и пшено (а) и тщательно перемешать их, увидим, что объем смеси менше суммы объемов ее компонентов (6). Это можно объяснить тем, что зерна пшена попали в промежутки между горошинами'' |
| | | | |
| - | ''Рис. 2.13. Моделирование явления уменьшения объема в результате смешивания различных жидкостей. Если взять горох и пшено (а) и тщательно перемешать их, увидим, что объем смеси менше суммы объемов <br>ее компонентов (6). Это можно объяснить тем, что зерна пшена попали в промежутки между горошинами''
| + | <br> |
| | | | |
| | + | [[Image:6.10-29.jpg|550px|Модели атома]] |
| | | | |
| | + | ''Рис. 2.14. Модели атома: а — планетарная модель: в центре атома — ядро, вокруг ядра вращаются электроны; б — современная: электроны как бы «размазаны» по орбиталям — некоторым частям пространства, окружающего ядро. Для наглядности расстояние от ядра до электронов показано в 2— 3 раза больше, чем диаметр ядра. На самом деле это расстояние превышает размеры ядра в 100000 раз''<br><br>Конечно, приведенные в этом параграфе данные — это только незначительная часть современных сведений об атомах и молекулах. С некоторыми другими их свойствами вы познакомитесь в следующих параграфах, кое о чем узнаете в старших классах. |
| | | | |
| - | [[Image:6.10-29.jpg]]
| + | <br> |
| - | | + | |
| - | ''Рис. 2.14. Модели атома: а — планетарная модель: в центре атома — ядро, вокруг ядра вращаются электроны; б — современная: электроны как бы «размазаны» по орбиталям — некоторым частям пространства, окружающего ядро. Для наглядности расстояние от ядра до электронов показано в 2— 3 раза больше, чем диаметр ядра. На самом деле это расстояние превышает размеры ядра в 100000 раз''<br><br>Конечно, приведенные в этом параграфе данные — это только незначительная часть современных сведений об атомах и молекулах. С некоторыми другими их свойствами вы познакомитесь в следующих параграфах, кое о чем узнаете в старших классах.
| + | |
| - | | + | |
| - | | + | |
| | | | |
| | *'''Подводим итоги''' | | *'''Подводим итоги''' |
| Строка 108: |
Строка 108: |
| | Все вещества состоят из мелких частичек — молекул или атомов. | | Все вещества состоят из мелких частичек — молекул или атомов. |
| | | | |
| - | Между молекулами (атомами) существуют промежутки. Молекулой называется наименьшая частичка вещества, имеющая его основные химические свойства и состоящая из атомов. Атом имеет сложную структуру и представляет собой положительно заряженное ядро, окруженное облаком легких частичек — электронов, имеющих отрицательный заряд. | + | Между молекулами (атомами) существуют промежутки. Молекулой называется наименьшая частичка вещества, имеющая его основные химические свойства и состоящая из атомов. Атом имеет сложную структуру и представляет собой положительно заряженное ядро, окруженное облаком легких частичек — электронов, имеющих [[Напряженность электрического поля. Принцип суперпозиции полей|отрицательный заряд]]. |
| | | | |
| - | '''<br>''' | + | '''<br>''' |
| | | | |
| | *'''Контрольные вопросы''' | | *'''Контрольные вопросы''' |
| | | | |
| - | ''1. Сколько разных видов атомов известно науке? Чем они отличаются друг от друга? '' | + | ''1. Сколько разных видов атомов известно науке? Чем они отличаются друг от друга? '' |
| | | | |
| - | ''2. Какие вещества называют простыми? Приведите примеры. '' | + | ''2. Какие вещества называют простыми? Приведите примеры. '' |
| | | | |
| - | ''3. Приведите примеры некоторых сложных веществ. Из каких атомов они состоят? '' | + | ''3. Приведите примеры некоторых сложных веществ. Из каких атомов они состоят? '' |
| - | | + | |
| - | ''4. Как можно доказать, что между частичками вещества существуют промежутки? ''
| + | |
| - | | + | |
| - | ''5. Как показать, что атомы и молекулы очень малы? ''
| + | |
| - | | + | |
| - | ''6. В переводе с греческого языка «атом» означает «неделимый». Так ли это?''
| + | |
| | | | |
| | + | ''4. Как можно доказать, что между частичками вещества существуют промежутки? '' |
| | | | |
| | + | ''5. Как показать, что атомы и молекулы очень малы? '' |
| | | | |
| | + | ''6. В переводе с греческого языка «атом» означает «неделимый». Так ли это?''<br> |
| | | | |
| | + | <br> |
| | | | |
| | *'''Упражнения''' | | *'''Упражнения''' |
| | | | |
| - | 1. Можем ли мы утверждать, что объем вещества в сосуде равняется сумме объемов молекул, из которых это вещество состоит?<br>2. Можем ли мы изменить объем тела, не изменяя количества молекул в нем? Как это сделать?<br>3. Известно, что при одинаковых условиях разные газы в одинаковом объеме содержат одно и то же количество молекул, а плотности газов различны. Чем можно объяснить расхождение в плотности газов?<br>4. Вычислите, сколько приблизительно молекул можно разместить вдоль отрезка длиной 0,5 мм. Диаметр молекулы считать равным 0,0000000001 м.<br>5. Известно, что наша Галактика Млечный Путь насчитывает около 9 млрд звезд. Во сколько раз количество молекул в 1 см<sup>3 </sup> воздуха, равное (при нормальных условиях) 3 • 10<sup>10</sup>, больше указанного ко<br>личества звезд?<br>6*.Площадь пленки, которую образует на поверхности воды капля масла объемом 0,005 мм<sup>3</sup>, не может превышать 50 см<sup>2</sup>. Какой вывод относительно размера молекул масла следует из этого факта? | + | 1. Можем ли мы утверждать, что объем вещества в сосуде равняется сумме объемов молекул, из которых это вещество состоит?<br>2. Можем ли мы изменить объем тела, не изменяя количества молекул в нем? Как это сделать?<br>3. Известно, что при одинаковых условиях разные газы в одинаковом объеме содержат одно и то же количество молекул, а плотности газов различны. Чем можно объяснить расхождение в плотности газов?<br>4. Вычислите, сколько приблизительно молекул можно разместить вдоль отрезка длиной 0,5 мм. Диаметр молекулы считать равным 0,0000000001 м.<br>5. Известно, что наша Галактика Млечный Путь насчитывает около 9 млрд звезд. Во сколько раз количество молекул в 1 см<sup>3 </sup> воздуха, равное (при нормальных условиях) 3 • 10<sup>10</sup>, больше указанного количества звезд?<br>6*.Площадь пленки, которую образует на поверхности воды капля масла объемом 0,005 мм<sup>3</sup>, не может превышать 50 см<sup>2</sup>. Какой вывод относительно размера молекул масла следует из этого факта? |
| - | | + | |
| | | | |
| | + | <br> |
| | | | |
| | *'''Экспериментальные задания ''' | | *'''Экспериментальные задания ''' |
| | | | |
| - | 1. Растворите крупинку краски в воде, налитой в прозрачный сосуд. Отлейте немного окрашенной воды в другой сосуд и долейте чистой воды. Сравните окраску раствора в первом и втором сосудах. Аналогично разбавьте раствор еще несколько раз. Сравните окраску последнего раствора с чистой водой. Объясните результат.<br>2. Сделайте из цветного пластилина модели двух молекул воды. Составьте из этих моделей модели молекул водорода и кислорода. | + | 1. Растворите крупинку краски в воде, налитой в прозрачный сосуд. Отлейте немного окрашенной воды в другой сосуд и долейте чистой воды. Сравните окраску раствора в первом и втором сосудах. Аналогично разбавьте раствор еще несколько раз. Сравните окраску последнего раствора с чистой водой. Объясните результат. |
| - | | + | |
| - | | + | |
| | | | |
| | + | 2. Сделайте из цветного пластилина модели двух молекул воды. Составьте из этих моделей модели молекул водорода и кислорода.<br> |
| | | | |
| | + | <br> |
| | | | |
| | *'''Физика и техника в Украине''' | | *'''Физика и техника в Украине''' |
| | | | |
| - | [[Image:6.10-30.jpg]] | + | [[Image:6.10-30.jpg|180px|Георгий Вячеславович Курдюмов]] |
| | | | |
| - | '''Георгий Вячеславович Курдюмов (1902-1996)''' — выдающийся металлофизик, профессор, академик российской и украинской академий наук. На протяжении длительного времени он [http://xvatit.com/busines/jobs-career/ работал] в Днепропетровске и Киеве, где создал современные научные школы по исследованию физики металлов и сплавов. | + | '''Георгий Вячеславович Курдюмов (1902-1996)''' — выдающийся металлофизик, профессор, академик российской и украинской академий наук. На протяжении длительного времени он [http://xvatit.com/busines/jobs-career/ работал] в Днепропетровске и Киеве, где создал современные научные школы по исследованию физики металлов и сплавов. |
| | | | |
| | Наиболее важными результатами его научной деятельности с практической точки зрения было создание научных основ термической обработки металлов — средств существенного упрочнения сталей — и создание новых материалов с уникальными свойствами. | | Наиболее важными результатами его научной деятельности с практической точки зрения было создание научных основ термической обработки металлов — средств существенного упрочнения сталей — и создание новых материалов с уникальными свойствами. |
| | | | |
| - | [http://xvatit.com/vuzi/ Академик] Курдюмов также известен своими фундаментальными исследованиями кристаллической структуры сталей и открытием так называемого «эффекта Курдюмова». | + | [http://xvatit.com/vuzi/ Академик] Курдюмов также известен своими фундаментальными исследованиями кристаллической структуры сталей и открытием так называемого «эффекта Курдюмова». |
| | | | |
| - | Президиум HAH Украины ввел премию им. Г. В. Курдюмова. | + | Президиум HAH Украины ввел премию им. Г. В. Курдюмова. |
| | | | |
| - | <br> ''Физика. 7 класс: Учебник / Ф. Я. Божинова, Н. М. Кирюхин, Е. А. Кирюхина. — X.: Издательство «Ранок», 2007. — 192 с.: ил.'' | + | <br> ''Физика. 7 класс: Учебник / Ф. Я. Божинова, Н. М. Кирюхин, Е. А. Кирюхина. — X.: Издательство «Ранок», 2007. — 192 с.: ил.'' |
| | | | |
| | '''<u>Содержание урока</u>''' | | '''<u>Содержание урока</u>''' |
Текущая версия на 10:28, 16 октября 2012
Гипермаркет знаний>>Физика>>Физика 7 класс>> Строение вещества. Атомы и молекулы
- Из чего состоят вещества? Насколько малыми являются наименьшие частички вещества? Существует ли отличие между молекулами одного и того же вещества? Можно ли сосчитать молекулы в булавочной головке? Эти и другие вопросы мы обсудим подробнее и вместе найдем ответы.
1. Различаем атом и молекулу
Из предыдущего курса «Природоведение» вы уже знаете, что все вещества состоят из мелких частичек — молекул и атомов. Вы также знаете, что первичные составные части вещества — атомы — имеют специальные названия и символы для обозначения каждого из видов атомов. Например: водород (H), ртуть (Hg), кислород (О), углерод (С). Атомы разных видов отличаются друг от друга по своим химическим свойствам и массе. С физической величиной под названием «масса» вы уже познакомились в § 9. Что такое «химические свойства», вы узнаете из курса химии.
По положению на 2005 год науке известны только 116 различных видов атомов. «He может быть,— возразите вы.— Как это, только 116? Каждый из нас с легкостью перечислит 200—300, а может быть, и больше различных веществ». Да, действительно, в мире существуют миллионы разных веществ. Как же соединить существование только 116 различных видов атомов с миллионами разных веществ? Дело в том, что вещества по большей части состоят из молекул.
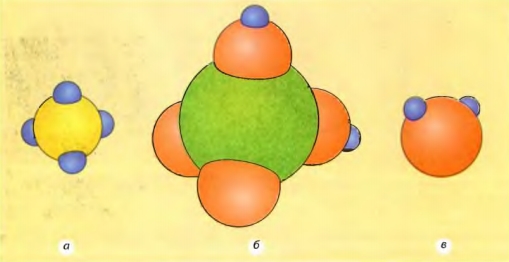
Рис. 2.11. Модели молекул некоторых веществ: а — метана (CH4); б — серной кислоты (H2SO4); в — воды (H2O). (Синие шарики — атомы водорода, красные — кислорода, зеленые — серы, желтые — углерода.)
Молекулой называется наименьшая частичка вещества, имеющая его основные химические свойства и состоящая из атомов.
Ситуация с разными веществами очень похожа на составление тысяч разных слов из «только» 32 различных букв алфавита. В этом сравнении каждая буква — это, так сказать, отдельный атом, а каждое слово соответствует молекуле, т.е. определенному веществу.
На рис. 2.11, а вы видите схематическое изображение молекулы метана, состоящей из пяти атомов: четырех атомов водорода и одного атома углерода. Пользуясь нашей аналогией,— это слово из пяти букв. На рис. 2.11, б приведена схема более сложной молекулы серной кислоты, состоящей из семи атомов. Аналог этой молекулы — слово из семи букв. Из приведенных примеров понятно, что каждая новая молекула (новая комбинация атомов) соответствует новому веществу.
2. Знакомимся с простыми и сложными веществами
Продолжим нашу аналогию сравнения веществ со словами. Вы, наверное, знаете, что рядом с обычными словами, состоящими из нескольких разных букв, мы иногда произносим и слова с использованием только одной буквы (например, «я», «а-а...», «у-у-у...»)... Так же и с веществами. Некоторые из них состоят только из одного вида атомов (одного химического элемента) и потому называются простыми (см. рис. 2.12). Примерами таких веществ является углерод, железо и др.
Совершенно очевидно, что слов, состоящих из нескольких букв, намного больше, чем слов из одной буквы. Так же и с веществами. Чаще всего в повседневной жизни мы сталкиваемся с веществами, молекулы которых состоят из атомов нескольких различных видов. Эти вещества так и называются — сложные (см. рис. 2.11).
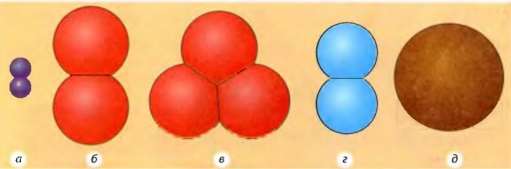
Рис. 2.12 Модели молекул простых веществ: а — водорода (H2); б — кислорода (O2); в — озона (O3); г — азота (N2); д — железа (Fe)
Напомним, что в научной литературе во избежание путаницы применяются разные названия для простых веществ и для химических элементов, из которых эти вещества состоят. Примеры названий простых веществ и соответствующих им химических элементов приведены в таблице.
| Название химического элемента
| Символ химического элемента
| Название соответствующего простого вещества
|
| Аурум
| Au
| Золото
|
| Гидроген
| H
| Водород
|
| Карбон
| С
| Углерод
|
| Купрум
| Cu
| Медь
|
| Нитроген
| N
| Азот
|
| Оксиген
| О
| Кислород
|
| Силициум
| Si
| Кремний
|
| Феррум
| Fe
| Железо
|
3. Убеждаемся в наличии промежутков между молекулами
После того как мы познакомились с наименьшими частичками вещества, давайте вспомним некоторые сведения о строении вещества.
В результате проведенных исследований ученые выяснили, что между молекулами (атомами) существуют промежутки. Этот вывод ученых можно легко подтвердить довольно простым опытом. Если смешать 100 мл воды и 100 мл спирта, то объем смеси будет меньше, чем 200 мл. Дело в том, что при смешивании двух жидкостей молекулы воды попадают в промежутки между молекулами спирта. Приведенный опыт можно смоделировать, например, с помощью пшена и гороха (рис. 2.13). Наполните стакан до половины пшеном, а потом прибавьте столько же гороха. Вы получите двухслойную композицию и полностью заполненный стакан. Аккуратно перемешайте эту композицию, и вы увидите, что объем смеси будет меньшим, чем исходный — часть пшена разместилась в пустотах между горошинами.
4. Пытаемся представить себе размеры атомов
Атомы очень малы. Выяснено, что размеры атомов приблизительно равны 10 10 г (0,0000000001 м). Чтобы представить, насколько мало значение этой величины, приведем такое сравнение: диаметр молекулы во столько же раз меньше диаметра яблока, во сколько раз диаметр яблока меньше диаметра Земли.
О размерах атомов также можно судить из такого примера. Если бы все люди нашей планеты проводили всю жизнь, занимаясь только счетом, то все вместе они смогли бы сосчитать атомы только в одной булавочной головке.
5. Вспоминаем строение атома
Опыты показали, что атом имеет сложную структуру. Он представляет собой положительно заряженное ядро, окруженное облаком легких частичек — электронов, имеющих отрицательный заряд (рис. 2.14). Масса ядра незначительно отличается от массы атома. Масса же электронов в сравнении с ядром очень мала.

Рис. 2.13. Моделирование явления уменьшения объема в результате смешивания различных жидкостей. Если взять горох и пшено (а) и тщательно перемешать их, увидим, что объем смеси менше суммы объемов ее компонентов (6). Это можно объяснить тем, что зерна пшена попали в промежутки между горошинами
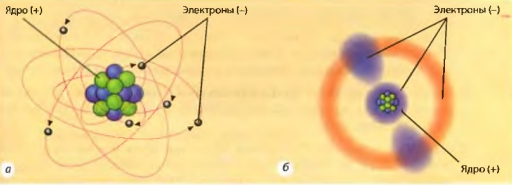
Рис. 2.14. Модели атома: а — планетарная модель: в центре атома — ядро, вокруг ядра вращаются электроны; б — современная: электроны как бы «размазаны» по орбиталям — некоторым частям пространства, окружающего ядро. Для наглядности расстояние от ядра до электронов показано в 2— 3 раза больше, чем диаметр ядра. На самом деле это расстояние превышает размеры ядра в 100000 раз
Конечно, приведенные в этом параграфе данные — это только незначительная часть современных сведений об атомах и молекулах. С некоторыми другими их свойствами вы познакомитесь в следующих параграфах, кое о чем узнаете в старших классах.
Все вещества состоят из мелких частичек — молекул или атомов.
Между молекулами (атомами) существуют промежутки. Молекулой называется наименьшая частичка вещества, имеющая его основные химические свойства и состоящая из атомов. Атом имеет сложную структуру и представляет собой положительно заряженное ядро, окруженное облаком легких частичек — электронов, имеющих отрицательный заряд.
1. Сколько разных видов атомов известно науке? Чем они отличаются друг от друга?
2. Какие вещества называют простыми? Приведите примеры.
3. Приведите примеры некоторых сложных веществ. Из каких атомов они состоят?
4. Как можно доказать, что между частичками вещества существуют промежутки?
5. Как показать, что атомы и молекулы очень малы?
6. В переводе с греческого языка «атом» означает «неделимый». Так ли это?
1. Можем ли мы утверждать, что объем вещества в сосуде равняется сумме объемов молекул, из которых это вещество состоит?
2. Можем ли мы изменить объем тела, не изменяя количества молекул в нем? Как это сделать?
3. Известно, что при одинаковых условиях разные газы в одинаковом объеме содержат одно и то же количество молекул, а плотности газов различны. Чем можно объяснить расхождение в плотности газов?
4. Вычислите, сколько приблизительно молекул можно разместить вдоль отрезка длиной 0,5 мм. Диаметр молекулы считать равным 0,0000000001 м.
5. Известно, что наша Галактика Млечный Путь насчитывает около 9 млрд звезд. Во сколько раз количество молекул в 1 см3 воздуха, равное (при нормальных условиях) 3 • 1010, больше указанного количества звезд?
6*.Площадь пленки, которую образует на поверхности воды капля масла объемом 0,005 мм3, не может превышать 50 см2. Какой вывод относительно размера молекул масла следует из этого факта?
- Экспериментальные задания
1. Растворите крупинку краски в воде, налитой в прозрачный сосуд. Отлейте немного окрашенной воды в другой сосуд и долейте чистой воды. Сравните окраску раствора в первом и втором сосудах. Аналогично разбавьте раствор еще несколько раз. Сравните окраску последнего раствора с чистой водой. Объясните результат.
2. Сделайте из цветного пластилина модели двух молекул воды. Составьте из этих моделей модели молекул водорода и кислорода.
- Физика и техника в Украине

Георгий Вячеславович Курдюмов (1902-1996) — выдающийся металлофизик, профессор, академик российской и украинской академий наук. На протяжении длительного времени он работал в Днепропетровске и Киеве, где создал современные научные школы по исследованию физики металлов и сплавов.
Наиболее важными результатами его научной деятельности с практической точки зрения было создание научных основ термической обработки металлов — средств существенного упрочнения сталей — и создание новых материалов с уникальными свойствами.
Академик Курдюмов также известен своими фундаментальными исследованиями кристаллической структуры сталей и открытием так называемого «эффекта Курдюмова».
Президиум HAH Украины ввел премию им. Г. В. Курдюмова.
Физика. 7 класс: Учебник / Ф. Я. Божинова, Н. М. Кирюхин, Е. А. Кирюхина. — X.: Издательство «Ранок», 2007. — 192 с.: ил.
Содержание урока
 конспект урока и опорный каркас конспект урока и опорный каркас
 презентация урока презентация урока
 интерактивные технологии интерактивные технологии
 акселеративные методы обучения
Практика акселеративные методы обучения
Практика
 тесты, тестирование онлайн тесты, тестирование онлайн
 задачи и упражнения задачи и упражнения
 домашние задания домашние задания
 практикумы и тренинги практикумы и тренинги
 вопросы для дискуссий в классе
Иллюстрации вопросы для дискуссий в классе
Иллюстрации
 видео- и аудиоматериалы видео- и аудиоматериалы
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты
Дополнения комиксы, притчи, поговорки, кроссворды, анекдоты, приколы, цитаты
Дополнения
 рефераты рефераты
 шпаргалки шпаргалки
 фишки для любознательных фишки для любознательных
 статьи (МАН) статьи (МАН)
 литература основная и дополнительная литература основная и дополнительная
 словарь терминов
Совершенствование учебников и уроков словарь терминов
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 календарные планы календарные планы
 учебные программы учебные программы
 методические рекомендации методические рекомендации
 обсуждения обсуждения
 Идеальные уроки-кейсы Идеальные уроки-кейсы
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|















