|
|
|
| Строка 1: |
Строка 1: |
| | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 10 класс|Химия 10 класс]]>> Химия: Ароматические углеводороды''' | | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 10 класс|Химия 10 класс]]>> Химия: Ароматические углеводороды''' |
| | | | |
| - | ''Строение''<br><br>Важнейшее ароматическое соединение — бензол.<br><br>Предметом нашего рассмотрения будут бензол и его гомологи — продукты замещения одного или более атомов водорода в молекуле бензола на углеводородные остатки.<br><br>Первое ароматическое соединение — бензол — открыто в 1825 г. Фарадеем. Была установлена его молекулярная формула — С6Н6. Если сравнить его состав с составом предельного углеводорода, содержащего такое же количество атомов углерода, — гексаном (С6Н14), то можно заметить, что бензол содержит на восемь атомов водорода меньше. Как известно, к уменьшению количества атомов водорода в молекуле. Модель углеводорода приводит появление кратных молекулы бензола связей и циклов. В 1865 г. Кекуле предложил его структурную формулу как циклогексатриена-1,3,5.<br>бензол циклогексатриен-1,3,5.<br><br>Как вы видите, молекула, соответствующая формуле Кекуле, содержит двойные связи, следовательно, бензол должен иметь ненасыщенный характер, т. е. легко вступать в реакции присоединения: гидрирования, бромирования, гидратации и т. д.<br><br>Однако данные многочисленных экспериментов показали, что бензол вступает в реакции присоединения только в жестких условиях (при высоких температурах и освещении), устойчив к окислению. Наиболее характерными для него являются реакции замещения, следовательно, бензол по характеру ближе к предельным углеводородам.<br><br>Пытаясь объяснить эти несоответствия, многие ученые предлагали различные варианты структуры бензола.<br><br>В настоящее время бензол обозначают или формулой Кекуле, или шестиугольником, в котором изображают окружность:<br> | + | ''Строение''<br><br>Важнейшее ароматическое соединение — [[Ароматические_углеводороды._Бензол|бензол]].<br><br>Предметом нашего рассмотрения будут бензол и его гомологи — продукты замещения одного или более атомов водорода в молекуле бензола на углеводородные остатки.<br><br>Первое ароматическое соединение — бензол — открыто в 1825 г. Фарадеем. Была установлена его молекулярная формула — С6Н6. Если сравнить его состав с составом предельного [[Природные_источники_углеводородов|углеводорода]], содержащего такое же количество атомов углерода, — гексаном (С6Н14), то можно заметить, что бензол содержит на восемь атомов водорода меньше. Как известно, к уменьшению количества атомов водорода в молекуле. Модель углеводорода приводит появление кратных молекулы бензола связей и циклов. В 1865 г. Кекуле предложил его структурную формулу как циклогексатриена-1,3,5.<br>бензол циклогексатриен-1,3,5.<br><br>Как вы видите, молекула, соответствующая формуле Кекуле, содержит двойные связи, следовательно, бензол должен иметь ненасыщенный характер, т. е. легко вступать в реакции присоединения: гидрирования, бромирования, гидратации и т. д.<br><br>Однако данные многочисленных экспериментов показали, что бензол вступает в реакции присоединения только в жестких условиях (при высоких температурах и освещении), устойчив к окислению. Наиболее характерными для него являются реакции замещения, следовательно, бензол по характеру ближе к предельным углеводородам.<br><br>Пытаясь объяснить эти несоответствия, многие ученые предлагали различные варианты структуры бензола.<br><br>В настоящее время бензол обозначают или формулой Кекуле, или шестиугольником, в котором изображают окружность:<br> |
| | | | |
| - | [[Image:himR10-41.jpg]] | + | [[Image:HimR10-41.jpg|Ароматические углеводороды]] |
| | | | |
| | + | <br> |
| | | | |
| | + | Так в чем же состоит особенность структуры бензола? На основании данных исследований и расчетов сделан вывод о том, что все шесть углеродных атомов находятся в состоянии sр<sup>2</sup>-гибридизации и лежат в одной плоскости. Негибридизованные р-орбитали атомов [[Валентные_состояния_атома_углерода|углерода]], составляющие двойные связи (формула Кекуле), перпендикулярны плоскости кольца и параллельны друг другу.<br><br>Они перекрываются между собой, образуя единую тс-систему. Таким образом, система чередующихся двойных связей, изображенных в формуле Кекуле, является циклической системой сопряженных, перекрывающихся между собой ''п''-связей.<br> |
| | | | |
| - | Так в чем же состоит особенность структуры бензола? На основании данных исследований и расчетов сделан вывод о том, что все шесть углеродных атомов находятся в состоянии sр<sup>2</sup>-гибридизации и лежат в одной плоскости. Негибридизованные р-орбитали атомов углерода, составляющие двойные связи (формула Кекуле), перпендикулярны плоскости кольца и параллельны друг другу.<br><br>Они перекрываются между собой, образуя единую тс-систему. Таким образом, система чередующихся двойных связей, изображенных в формуле Кекуле, является циклической системой сопряженных, перекрывающихся между собой ''п''-связей.<br>
| + | Эта система представляет собой две тороидальные (похожие на бублик) области электронной плотности, лежащие по обе стороны бензольного кольца. Из всего сказанного можно сделать вывод, что изображать бензол в виде правильного шестиугольника с окружностью в центре (''g''-система) более логично, чем в виде циклогексатриена-1,3,5.<br><br>Американский ученый Л. Полинг предложил представлять бензол в виде двух граничных структур, отличающихся распределением электронной плотности и постоянно переходящих друг в друга, т. е. считать его промежуточным соединением, «усреднением» двух структур.<br><br>Данные измерения длин связей подтверждают эти предположения. Выяснено, что все С—С связи в бензоле имеют одинаковую длину (0,139 нм). Они несколько короче одинарных С—С связей (0,154 нм) и длиннее двойных (0,132 нм). Существуют также соединения, молекулы которых содержат несколько циклических структур. |
| | | | |
| - | Эта система представляет собой две тороидальные (похожие на бублик) области электронной плотности, лежащие по обе стороны бензольного кольца. Из всего сказанного можно сделать вывод, что изображать бензол в виде правильного шестиугольника с окружностью в центре (''g''-система) более логично, чем в виде циклогексатриена-1,3,5.<br><br>Американский ученый Л. Полинг предложил представлять бензол в виде двух граничных структур, отличающихся распределением электронной плотности и постоянно переходящих друг в друга, т. е. считать его промежуточным соединением, «усреднением» двух структур.<br><br>Данные измерения длин связей подтверждают эти предположения. Выяснено, что все С—С связи в бензоле имеют одинаковую длину (0,139 нм). Они несколько короче одинарных С—С связей (0,154 нм) и длиннее двойных (0,132 нм). Существуют также соединения, молекулы которых содержат несколько циклических структур.
| + | ''Изомерия и номенклатура''<br><br>Для гомологов бензола характерна изомерия положения нескольких заместителей. Простейший гомолог бензола — толуол (метил-бензол) не имеет таких изомеров, следующий гомолог представлен в виде четырех изомеров:<br>[[Image:HimR10-42.jpg|Ароматические углеводороды]] |
| | | | |
| - | ''Изомерия и номенклатура''<br><br>Для гомологов бензола характерна изомерия положения нескольких заместителей. Простейший гомолог бензола — толуол (метил-бензол) не имеет таких изомеров, следующий гомолог представлен в виде четырех изомеров:<br>[[Image:himR10-42.jpg]]
| + | <br> |
| | | | |
| | + | Основой названия ароматического углеводорода с небольшими заместителями является слово бензол. Атомы в ароматическом кольце нумеруют, начиная от старшего заместителя к младшему:<br> |
| | | | |
| | + | [[Image:HimR10-43.jpg|Ароматические углеводороды]] |
| | | | |
| - | Основой названия ароматического углеводорода с небольшими заместителями является слово бензол. Атомы в ароматическом кольце нумеруют, начиная от старшего заместителя к младшему:<br>
| + | <br> |
| | | | |
| - | [[Image:himR10-43.jpg]] | + | По старой, но до сих пор часто используемой номенклатуре положения 2 и 6 называют орто-положениями, 4 — пара-, а 3 и 5 — жета-положениями.<br><br>''Физические свойства''<br><br>Бензол и его простейшие гомологи в обычных условиях весьма токсичные жидкости с характерным неприятным запахом. Они плохо растворяются в воде, но хорошо — в органических растворителях.<br><br>''Способы получения''<br><br>Основным источником промышленного получения бензола и его гомологов является нефть и каменноугольная смола — один из продуктов сухой перегонки (коксования) каменного угля.<br><br>Среди синтетических способов получения аренов можно выделить две группы: получение собственно ароматического кольца и введение в кольцо углеводородного заместителя.<br><br><u>''Для получения бензола''</u> и его гомологов можно использовать следующие реакции:<br><br>1. Дегидрирование циклогексана<br>[[Image:HimR10-44.jpg|Ароматические углеводороды]] |
| | | | |
| | + | <br> |
| | | | |
| | + | 2. Ароматизация (дегидроциклизация) [[Алканы_(Химия_10_класс)|алканов]]. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:<br> |
| | | | |
| - | По старой, но до сих пор часто используемой номенклатуре положения 2 и 6 называют орто-положениями, 4 — пара-, а 3 и 5 — жета-положениями.<br><br>''Физические свойства''<br><br>Бензол и его простейшие гомологи в обычных условиях весьма токсичные жидкости с характерным неприятным запахом. Они плохо растворяются в воде, но хорошо — в органических растворителях.<br><br>''Способы получения''<br><br>Основным источником промышленного получения бензола и его гомологов является нефть и каменноугольная смола — один из продуктов сухой перегонки (коксования) каменного угля.<br><br>Среди синтетических способов получения аренов можно выделить две группы: получение собственно ароматического кольца и введение в кольцо углеводородного заместителя.<br><br><u>''Для получения бензола''</u> и его гомологов можно использовать следующие реакции:<br><br>1. Дегидрирование циклогексана<br>[[Image:himR10-44.jpg]]
| + | [[Image:HimR10-45.jpg|Ароматические углеводороды]] |
| | | | |
| | + | <br> |
| | | | |
| | + | Ввести углеводородный заместитель в ароматическое кольцо (провести алкилирование) можно несколькими способами.<br><br>4. Синтез Вюрца. Это модификация уже известного нам способа получения алканов:<br>[[Image:HimR10-46.jpg|Ароматические углеводороды]] |
| | | | |
| - | 2. Ароматизация (дегидроциклизация) алканов. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:<br>
| + | <br> |
| | | | |
| - | [[Image:himR10-45.jpg]] | + | ''Химические свойства''<br><br>''Реакции замещения''<br><br>Ароматические углеводороды вступают в реакции замещения.<br><br>1. Бромирование. При реакции с бромом в присутствии катализатора, бромида железа(ІІІ), один из атомов водорода в бензольном кольце может замещаться на атом брома:<br>[[Image:HimR10-47.jpg|Ароматические углеводороды]] |
| | | | |
| | + | <br> |
| | | | |
| | + | 2. Нитрирование. Большое промышленное значение ва и его гомологов. При взаимодействии ароматического углеводорода с азотной кислотой в присутствии серной (смесь серной и азотной кислот называют нитрующей смесью) происходит замещение атома водорода на нитрогруппу —NO<sub>2</sub>. |
| | | | |
| - | Ввести углеводородный заместитель в ароматическое кольцо (провести алкилирование) можно несколькими способами.<br><br>4. Синтез Вюрца. Это модификация уже известного нам способа получения алканов:<br>[[Image:himR10-46.jpg]]
| + | Восстановлением образовавшегося в этой реакции нитробензола получают анилин — вещество, которое применяется для получения анилиновых красителей. Эта реакция носит имя замечательного русского химика Зинина. |
| | | | |
| | + | ''Реакции присоединения''<br><br>Ароматические соединения могут вступать и в реакции присоединения к бензольному кольцу. При этом образуются циклогексан или его производные.<br><br>1. Гидрирование. Каталитическое гидрирование бензола протекает при более высокой температуре, чем гидрирование [[Алкены|алкенов]].<br> |
| | | | |
| | + | 2. Хлорирование. Реакция идет при освещении ультрафиолетовым светом и является свободнорадикальной.<br> |
| | | | |
| - | ''Химические свойства''<br><br>''Реакции замещения''<br><br>Ароматические углеводороды вступают в реакции замещения.<br><br>1. Бромирование. При реакции с бромом в присутствии катализатора, бромида железа(ІІІ), один из атомов водорода в бензольном кольце может замещаться на атом брома:<br>[[Image:himR10-47.jpg]]
| + | Электрофильное замещение<br><br>Реакции замещения (бромирования и нитрования), упомянутые выше, протекают под воздействием электрофильных частиц, т. е. являются реакциями электрофильного замещения. Интересно, что они только формально (по конечному результату) относятся к реакциям замещения, а на самом деле это последовательность реакций присоединения и отщепления.<br><br>Механизм реакции электрофильного замещения.<br><br>Ароматическая структура бензола и подобных ему соединений обладает повышенной устойчивостью, и нарушение ее энергетически невыгодно. Это оказывает влияние на химические свойства ароматических соединений.<br><br>Наличие ''п''-системы, области повышенной электронной плотности, делает структуру бензола выгодной для воздействия элек-трофилов, но, в отличие от непредельных соединений, эти реакции протекают не как присоединение, а как замещение.<br><br>Сравним механизмы реакций бромирования этена и бензола:<br>[[Image:HimR10-48.jpg|Ароматические углеводороды]] |
| | | | |
| | + | <br> |
| | | | |
| | + | Присоединение брома к этену начинается с электрофильной атаки, которую мы формально, для упрощения рассуждений, представим как взаимодействие электронов ''п''-связи с катионом брома.<br><br>Электрофильная частица, катион брома, образуется при гетеро-литическом расщеплении связи Вr—Вr, в результате которого появляется два иона:<br><br>Вr2 —> Вг<sup>+</sup> + Вг<sup>-</sup><br><br>Катион брома взаимодействует с молекулой этена и образует ''п''-комплекс. При взаимодействии катиона брома с л-системой ароматического кольца также образуется ''п''-комплекс, который отличается от соответствующей структуры, образованной этеном, тем, что незанятая орбиталь Вг+ в случае реакции с ароматическим соединением перекрывается с несколькими р-орбиталями, ''п''-системой в целом. |
| | | | |
| - | 2. Нитрирование. Большое промышленное значение ва и его гомологов. При взаимодействии ароматического углеводорода с азотной кислотой в присутствии серной (смесь серной и азотной кислот называют нитрующей смесью) происходит замещение атома водорода на нитрогруппу —NO<sub>2</sub>.
| + | <br>Следующей переходной частицей после л-комплекса, образованного этеном и катионом брома, является карбокатион:<br>[[Image:HimR10-49.jpg|Ароматические углеводороды]] |
| | | | |
| - | Восстановлением образовавшегося в этой реакции нитробензола получают анилин — вещество, которое применяется для получения анилиновых красителей. Эта реакция носит имя замечательного русского химика Зинина.
| + | <br> |
| | | | |
| - | ''Реакции присоединения''<br><br>Ароматические соединения могут вступать и в реакции присоединения к бензольному кольцу. При этом образуются циклогексан или его производные.<br><br>1. Гидрирование. Каталитическое гидрирование бензола протекает при более высокой температуре, чем гидрирование алкенов.<br> | + | Обратите внимание, что образование этого комплекса приводит к переходу одного из атомов углерода в sр<sup>3</sup>-гибридизацию, нарушению циклической ''п''-системы (ароматичности), снижению устойчивости соединения.<br><br>По этой причине, в отличие от реакции бромирования алкена, которая заканчивается присоединением аниона брома к карбока-тиону и образованию 1,2-дибромэтана.<br> |
| | | | |
| - | 2. Хлорирование. Реакция идет при освещении ультрафиолетовым светом и является свободнорадикальной.<br>
| + | Þ-комплекс стабилизируется в результате отщепления протона, и происходит восстановление ароматичности:<br><br>Таким образом, мы показали, что невыгодность нарушения ароматичности, которое происходит при нарушении цикличности Þ-системы, приводит к затруднению реакций присоединения к ароматическим системам и большей вероятности реакций замещения.<br><br>Þ-Система бензольного кольца является менее реакционноспособной структурой, чем Þ-связь в алкенах, поэтому для успешного протекания реакций необходимо применение катализаторов.<br><br>Катализатором описанной выше реакции является бромид [[Функция_желез_внутренней_секреции|железа]](III), который, присоединяясь к молекуле брома, способствует образованию частицы Вг+ — активного электрофила. По электрофильному механизму идут многие реакции, в которых принимает участие бензол и другие ароматические соединения.<br><br>''Нитрование''<br>[[Image:HimR10-50.jpg|Ароматические углеводороды]] |
| | | | |
| - | Электрофильное замещение<br><br>Реакции замещения (бромирования и нитрования), упомянутые выше, протекают под воздействием электрофильных частиц, т. е. являются реакциями электрофильного замещения. Интересно, что они только формально (по конечному результату) относятся к реакциям замещения, а на самом деле это последовательность реакций присоединения и отщепления.<br><br>Механизм реакции электрофильного замещения.<br><br>Ароматическая структура бензола и подобных ему соединений обладает повышенной устойчивостью, и нарушение ее энергетически невыгодно. Это оказывает влияние на химические свойства ароматических соединений.<br><br>Наличие ''п''-системы, области повышенной электронной плотности, делает структуру бензола выгодной для воздействия элек-трофилов, но, в отличие от непредельных соединений, эти реакции протекают не как присоединение, а как замещение.<br><br>Сравним механизмы реакций бромирования этена и бензола:<br>[[Image:himR10-48.jpg]]
| + | <br> |
| | | | |
| | + | В данном случае карбокатион образуется при отщеплении хлора от хлорэтана под воздействием катализатора — АlСl<sub>3</sub>. Ацилирование (введение ацильной группы) |
| | | | |
| | + | [[Image:HimR10-51.jpg|Ароматические углеводороды]] |
| | | | |
| - | Присоединение брома к этену начинается с электрофильной атаки, которую мы формально, для упрощения рассуждений, представим как взаимодействие электронов ''п''-связи с катионом брома.<br><br>Электрофильная частица, катион брома, образуется при гетеро-литическом расщеплении связи Вr—Вr, в результате которого появляется два иона:<br><br>Вr2 —> Вг<sup>+</sup> + Вг<sup>-</sup><br><br>Катион брома взаимодействует с молекулой этена и образует ''п''-комплекс. При взаимодействии катиона брома с л-системой ароматического кольца также образуется ''п''-комплекс, который отличается от соответствующей структуры, образованной этеном, тем, что незанятая орбиталь Вг+ в случае реакции с ароматическим соединением перекрывается с несколькими р-орбиталями, ''п''-системой в целом.
| + | <br> |
| | | | |
| - | <br>Следующей переходной частицей после л-комплекса, образованного этеном и катионом брома, является карбокатион:<br>[[Image:himR10-49.jpg]] | + | ''Ориентирующее действие заместителей''<br><br>В молекуле бензола все атомы углерода эквивалентны. Элек-трофил может с равной вероятностью заместить катион водорода при любом из них. Но в случае наличия хотя бы одного заместителя реакция становится неоднозначной.<br><br>Влияние заместителей при бензольном кольце на направление реакции электрофильного замещения называют ориентирующим действием заместителей.<br><br>Можно однозначно сформулировать правило:<br><br>• донорные, подающие электронную плотность заместители направляют реакции электрофильного замещения во 2, 4, 6 (орто-, пара-) положения, как правило, повышают скорость реакции и называются заместителями (ориентантами) первого (I) рода;<br><br>• акцепторные, принимающие электронную плотность заместители направляют реакции электрофильного замещения в 3, 5 (мета-) положения, снижают скорость реакции и называются заместителями второго рода.<br><br>Для того чтобы объяснить это, надо рассмотреть устойчивость промежуточной частицы — Þ-комплекса, который образуется на одной из стадий реакции. Электрофил может присоединиться к разным атомам углерода. При этом образуется три варианта частиц:<br>[[Image:HimR10-52.jpg|Ароматические углеводороды]] |
| | | | |
| | + | <br> |
| | | | |
| | + | Наиболее устойчивый Þ-комплекс и определит направление реакции.<br><br>Для оценки устойчивости переходного состояния воспользуемся теорией резонанса. По этой теории каждая переходная частица будет описываться набором граничных (канонических) структур, образующихся при «перетекании» электронной плотности по системе сопряженных кратных связей:<br><br>Атака по атомам 2 и 6 (орто-положения)<br>[[Image:HimR10-53.jpg|Ароматические углеводороды]] |
| | | | |
| - | Обратите внимание, что образование этого комплекса приводит к переходу одного из атомов углерода в sр<sup>3</sup>-гибридизацию, нарушению циклической ''п''-системы (ароматичности), снижению устойчивости соединения.<br><br>По этой причине, в отличие от реакции бромирования алкена, которая заканчивается присоединением аниона брома к карбока-тиону и образованию 1,2-дибромэтана.<br>
| + | <br> |
| | | | |
| - | Þ-комплекс стабилизируется в результате отщепления протона, и происходит восстановление ароматичности:<br><br>Таким образом, мы показали, что невыгодность нарушения ароматичности, которое происходит при нарушении цикличности Þ-системы, приводит к затруднению реакций присоединения к ароматическим системам и большей вероятности реакций замещения.<br><br>Þ-Система бензольного кольца является менее реакционноспособной структурой, чем Þ-связь в алкенах, поэтому для успешного протекания реакций необходимо применение катализаторов.<br><br>Катализатором описанной выше реакции является бромид железа(III), который, присоединяясь к молекуле брома, способствует образованию частицы Вг+ — активного электрофила. По электрофильному механизму идут многие реакции, в которых принимает участие бензол и другие ароматические соединения.<br><br>''Нитрование''<br>[[Image:himR10-50.jpg]]
| + | Видно, что при направлении атаки электрофила в сторону атомов 2, 4 и 6 образуется Þ-комплекс, причем одна из граничных структур содержит положительный заряд на атоме углерода, при котором находится заместитель. Если заместитель донорный, обладает положительным индуктивным или мезомерным эффектом, то именно эти структуры будут стабилизированы за счет частичной скомпенсированности положительного заряда. |
| | | | |
| | + | Наличие акцепторного, обладающего отрицательным индуктивным или мезомерным эффектом заместителя приведет к уменьшению стабильности таких граничных структур и Þ-комплекса в целом.<br> |
| | | | |
| | + | В случае атаки по направлению атомов 3 и 5 не образуется ни одной структуры с положительным зарядом на атоме углерода при заместителе. В связи с этим наличие акцепторного заместителя не приведет к существенному снижению устойчивости переходного состояния именно в этом случае.<br><br>Характер электронных эффектов групп атомов мы обсуждали в § 9. Одним из заместителей с положительным индуктивным эффектом мы назвали метильную группу —СН<sub>3</sub>. Эта группа является ориентантом первого рода. Поэтому метилбензол (толуол) будет нитроваться в положения 2, 4, 6. |
| | | | |
| - | В данном случае карбокатион образуется при отщеплении хлора от хлорэтана под воздействием катализатора — АlСl<sub>3</sub>. Ацилирование (введение ацильной группы)
| + | <br> |
| | | | |
| - | [[Image:himR10-51.jpg]] | + | Образовавшееся соединение 2,4,6-тринитротолуол (тол, тротил) применяется как взрывчатое вещество.<br><br>В те же положения будет происходить бромирование гидрокси-бензола (фенола). Гидроксильная группа является ориентантом первого рода, так как обладает неподеленной парой электронов и проявляется ''+М-эффект.''<br><br>Стабилизация промежуточной частицы, Þ-комплекса, происходит за счет перекрывания орбитали кислорода, на которой находится неподеленная пара электронов, и незаполненной орбитали углерода. При этом происходит образование дополнительной связи по донорно-акцепторному механизму. Таким образом, неподеленная электронная пара [[Кислород|кислорода ]]гид-роксильной группы и сопрягается с Þ-системой бензольного кольца (р — ''п''-сопряжение).<br><br>Акцепторная, обладающая -І-эффектом группа—СР3 в молекуле трифторметилбензола направляет реакции электрофильного замещения в 3 или 5 положение<br>[[Image:HimR10-54.jpg|Ароматические углеводороды]] |
| | | | |
| | + | <br> |
| | | | |
| | + | [[Image:HimR10-55.jpg|Ароматические углеводороды]] |
| | | | |
| - | ''Ориентирующее действие заместителей''<br><br>В молекуле бензола все атомы углерода эквивалентны. Элек-трофил может с равной вероятностью заместить катион водорода при любом из них. Но в случае наличия хотя бы одного заместителя реакция становится неоднозначной.<br><br>Влияние заместителей при бензольном кольце на направление реакции электрофильного замещения называют ориентирующим действием заместителей.<br><br>Можно однозначно сформулировать правило:<br><br>• донорные, подающие электронную плотность заместители направляют реакции электрофильного замещения во 2, 4, 6 (орто-, пара-) положения, как правило, повышают скорость реакции и называются заместителями (ориентантами) первого (I) рода;<br><br>• акцепторные, принимающие электронную плотность заместители направляют реакции электрофильного замещения в 3, 5 (мета-) положения, снижают скорость реакции и называются заместителями второго рода.<br><br>Для того чтобы объяснить это, надо рассмотреть устойчивость промежуточной частицы — Þ-комплекса, который образуется на одной из стадий реакции. Электрофил может присоединиться к разным атомам углерода. При этом образуется три варианта частиц:<br>[[Image:himR10-52.jpg]]
| + | <br> |
| | | | |
| | + | Заместители, обладающие различными ориентирующими свойствами, представлены в таблице 4.<br><br>''Реакции по алкильному заместителю''<br><br>Рассмотрим эти реакции на примере гомолога бензола — толуола.<br><br>Как уже было показано выше, метильная группа проявляет положительный индуктивный эффект по отношению к бензольному кольцу. Соответственно бензольное кольцо обладает отрицательным индуктивным эффектом по отношению к метильной группе. В результате этого она становится значительно более активной по сравнению с метильной группой в алифатических соединениях. Ал-кильные производные бензола гораздо охотнее и при более мягких условиях вступают в реакции свободнорадикального замещения (например, хлорирования) на свету, причем замещается водород в основном при атоме, который непосредственно присоединен к бензольному кольцу:<br>[[Image:HimR10-56.jpg|Ароматические углеводороды]] |
| | | | |
| | + | <br> |
| | | | |
| - | Наиболее устойчивый Þ-комплекс и определит направление реакции.<br><br>Для оценки устойчивости переходного состояния воспользуемся теорией резонанса. По этой теории каждая переходная частица будет описываться набором граничных (канонических) структур, образующихся при «перетекании» электронной плотности по системе сопряженных кратных связей:<br><br>Атака по атомам 2 и 6 (орто-положения)<br>[[Image:himR10-53.jpg]]
| + | Кроме того, толуол можно окислить водным раствором перман-ганата калия, подкисленного серной кислотой, с образованием бензойной кислоты. Подобная реакция совершенно нехарактерна для алканов.<br><br>''Применение бензола и его гомологов''<br><br>Бензол применяется как растворитель и сырье для получения многочисленных и очень важных ароматических соединений, которые используются для производства красителей (анилин), [[Полимеры|полимеров ]](стирол, фенол, анилин), лекарственных препаратов (схема 6). Нитрованием толуола получают 2,4,6-тринитротолуол (тол, тротил) — мощное взрывчатое вещество.<br>[[Image:HimR10-57.jpg|Ароматические углеводороды]] |
| | | | |
| | + | <br>Окисление толуола, как уже было показано выше, дает бензойную кислоту, которая также является полупродуктом для получения многих важных органических соединений, применяется как сильный консервант (именно благодаря наличию большого количества бензойной кислоты долго не портятся некоторые ягоды — брусника, клюква).<br><br>Продукт окисления 1,4-диметилбензола (пара-ксилола) — терефталевая кислота применяется для получения полимерного материала — полиэфирного волокна лавсана. |
| | | | |
| | + | <br> |
| | | | |
| - | Видно, что при направлении атаки электрофила в сторону атомов 2, 4 и 6 образуется Þ-комплекс, причем одна из граничных структур содержит положительный заряд на атоме углерода, при котором находится заместитель. Если заместитель донорный, обладает положительным индуктивным или мезомерным эффектом, то именно эти структуры будут стабилизированы за счет частичной скомпенсированности положительного заряда.
| + | 1. Напишите формулы возможных изомеров углеводорода состава С9Н12, относящегося к ароматическому ряду.<br><br>2. Какие ароматические углеводороды могут образоваться при дегидроциклизации к-октана?<br><br>3. При хлорировании толуола в присутствии хлорида железа(III) получено два соединения с молекулярной формулой С7Н7Сl. Хлорирование толуола на свету приводит также к соединению с молекулярной формулой С7Н7Сl. Что это за соединения? Напишите уравнения соответствующих реакций.<br><br>4. Соединение А состава С7Н8 нитруется азотной [[Нітратна_кислота_і_нітрати,_їх_поширення_в_природі|кислотой ]]в присутствии серной кислоты с образованием смеси соединений Б и В, имеющих общую формулу С7Н7N02. Окисление соединения А перманганатом калия в кислой среде приводит к соединению Г формулы С7Н602. Назовите соединения А, Б, В и Г, напишите уравнения соответствующих реакций.<br><br>5. Сколько граммов бензола прореагировало с бромом в присутствии бромида железа(Ш), если выделилось 224 мл бромистого водорода (н. у.)?<br><br>6. Сколько литров водорода (н. у.) могут присоединить в присутствии катализатора 100 г смеси, состоящей из 25% бензола, 15% толуола, 25% гексена и 35% гексана?<br><br>7. При нитровании 15,6 г бензола смесью концентрированных азотной и серной кислот выход мононитропро-изводного составил 70%. Сколько граммов продукта получено?<br><br>8*. Углеводород состава С9Н8 обесцвечивает бромную воду, при окислении образует бензойную кислоту, с аммиачным раствором оксида серебра дает осадок. Установите строение углеводорода, приведите уравнения соответствующих реакций.<br><br>9*. Напишите уравнения реакций, с помощью которых можно получить стирол, используя только неорганические соединения. |
| | | | |
| - | Наличие акцепторного, обладающего отрицательным индуктивным или мезомерным эффектом заместителя приведет к уменьшению стабильности таких граничных структур и Þ-комплекса в целом.<br>
| + | <br> |
| | | | |
| - | В случае атаки по направлению атомов 3 и 5 не образуется ни одной структуры с положительным зарядом на атоме углерода при заместителе. В связи с этим наличие акцепторного заместителя не приведет к существенному снижению устойчивости переходного состояния именно в этом случае.<br><br>Характер электронных эффектов групп атомов мы обсуждали в § 9. Одним из заместителей с положительным индуктивным эффектом мы назвали метильную группу —СН<sub>3</sub>. Эта группа является ориентантом первого рода. Поэтому метилбензол (толуол) будет нитроваться в положения 2, 4, 6.
| + | <br> <sub>интерактивные технологии для [[Химия|урока химии]], словарь терминов [[Химия 10 класс|по химии]], помощь ученикам [[Гипермаркет знаний - первый в мире!|в подготовке домашнего задания]]</sub> |
| - | | + | |
| - | | + | |
| - | | + | |
| - | Образовавшееся соединение 2,4,6-тринитротолуол (тол, тротил) применяется как взрывчатое вещество.<br><br>В те же положения будет происходить бромирование гидрокси-бензола (фенола). Гидроксильная группа является ориентантом первого рода, так как обладает неподеленной парой электронов и проявляется ''+М-эффект.''<br><br>Стабилизация промежуточной частицы, Þ-комплекса, происходит за счет перекрывания орбитали кислорода, на которой находится неподеленная пара электронов, и незаполненной орбитали углерода. При этом происходит образование дополнительной связи по донорно-акцепторному механизму. Таким образом, неподеленная электронная пара кислорода гид-роксильной группы и сопрягается с Þ-системой бензольного кольца (р — ''п''-сопряжение).<br><br>Акцепторная, обладающая -І-эффектом группа—СР3 в молекуле трифторметилбензола направляет реакции электрофильного замещения в 3 или 5 положение<br>[[Image:himR10-54.jpg]]
| + | |
| - | | + | |
| - | | + | |
| - | | + | |
| - | [[Image:himR10-55.jpg]]
| + | |
| - | | + | |
| - | | + | |
| - | | + | |
| - | Заместители, обладающие различными ориентирующими свойствами, представлены в таблице 4.<br><br>''Реакции по алкильному заместителю''<br><br>Рассмотрим эти реакции на примере гомолога бензола — толуола.<br><br>Как уже было показано выше, метильная группа проявляет положительный индуктивный эффект по отношению к бензольному кольцу. Соответственно бензольное кольцо обладает отрицательным индуктивным эффектом по отношению к метильной группе. В результате этого она становится значительно более активной по сравнению с метильной группой в алифатических соединениях. Ал-кильные производные бензола гораздо охотнее и при более мягких условиях вступают в реакции свободнорадикального замещения (например, хлорирования) на свету, причем замещается водород в основном при атоме, который непосредственно присоединен к бензольному кольцу:<br>[[Image:himR10-56.jpg]]
| + | |
| - | | + | |
| - | | + | |
| - | | + | |
| - | Кроме того, толуол можно окислить водным раствором перман-ганата калия, подкисленного серной кислотой, с образованием бензойной кислоты. Подобная реакция совершенно нехарактерна для алканов.<br><br>''Применение бензола и его гомологов''<br><br>Бензол применяется как растворитель и сырье для получения многочисленных и очень важных ароматических соединений, которые используются для производства красителей (анилин), полимеров (стирол, фенол, анилин), лекарственных препаратов (схема 6). Нитрованием толуола получают 2,4,6-тринитротолуол (тол, тротил) — мощное взрывчатое вещество.<br>[[Image:himR10-57.jpg]]
| + | |
| - | | + | |
| - | <br>Окисление толуола, как уже было показано выше, дает бензойную кислоту, которая также является полупродуктом для получения многих важных органических соединений, применяется как сильный консервант (именно благодаря наличию большого количества бензойной кислоты долго не портятся некоторые ягоды — брусника, клюква).<br><br>Продукт окисления 1,4-диметилбензола (пара-ксилола) — терефталевая кислота применяется для получения полимерного материала — полиэфирного волокна лавсана.
| + | |
| - | | + | |
| - | | + | |
| - | | + | |
| - | 1. Напишите формулы возможных изомеров углеводорода состава С9Н12, относящегося к ароматическому ряду.<br><br>2. Какие ароматические углеводороды могут образоваться при дегидроциклизации к-октана?<br><br>3. При хлорировании толуола в присутствии хлорида железа(III) получено два соединения с молекулярной формулой С7Н7Сl. Хлорирование толуола на свету приводит также к соединению с молекулярной формулой С7Н7Сl. Что это за соединения? Напишите уравнения соответствующих реакций.<br><br>4. Соединение А состава С7Н8 нитруется азотной кислотой в присутствии серной кислоты с образованием смеси соединений Б и В, имеющих общую формулу С7Н7N02. Окисление соединения А перманганатом калия в кислой среде приводит к соединению Г формулы С7Н602. Назовите соединения А, Б, В и Г, напишите уравнения соответствующих реакций.<br><br>5. Сколько граммов бензола прореагировало с бромом в присутствии бромида железа(Ш), если выделилось 224 мл бромистого водорода (н. у.)?<br><br>6. Сколько литров водорода (н. у.) могут присоединить в присутствии катализатора 100 г смеси, состоящей из 25% бензола, 15% толуола, 25% гексена и 35% гексана?<br><br>7. При нитровании 15,6 г бензола смесью концентрированных азотной и серной кислот выход мононитропро-изводного составил 70%. Сколько граммов продукта получено?<br><br>8*. Углеводород состава С9Н8 обесцвечивает бромную воду, при окислении образует бензойную кислоту, с аммиачным раствором оксида серебра дает осадок. Установите строение углеводорода, приведите уравнения соответствующих реакций.<br><br>9*. Напишите уравнения реакций, с помощью которых можно получить стирол, используя только неорганические соединения.
| + | |
| - | | + | |
| - | | + | |
| - | | + | |
| - | <br> <sub>интерактивные технологии для [[Химия|урока химии]], словарь терминов [[Химия_10_класс|по химии]], помощь ученикам [[Гипермаркет_знаний_-_первый_в_мире!|в подготовке домашнего задания]]</sub> | + | |
| | | | |
| | '''<u>Содержание урока</u>''' | | '''<u>Содержание урока</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] конспект урока ''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект урока ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] опорный каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] опорный каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентация урока | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентация урока |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративные методы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративные методы |
| - | [[Image:1236084776 kr.jpg|10x10px]] интерактивные технологии | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] интерактивные технологии |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачи и упражнения | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачи и упражнения |
| - | [[Image:1236084776 kr.jpg|10x10px]] самопроверка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] самопроверка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикумы, тренинги, кейсы, квесты | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикумы, тренинги, кейсы, квесты |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашние задания | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашние задания |
| - | [[Image:1236084776 kr.jpg|10x10px]] дискуссионные вопросы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] дискуссионные вопросы |
| - | [[Image:1236084776 kr.jpg|10x10px]] риторические вопросы от учеников | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] риторические вопросы от учеников |
| - |
| + | |
| | '''<u>Иллюстрации</u>''' | | '''<u>Иллюстрации</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] аудио-, видеоклипы и мультимедиа ''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] аудио-, видеоклипы и мультимедиа ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] фотографии, картинки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фотографии, картинки |
| - | [[Image:1236084776 kr.jpg|10x10px]] графики, таблицы, схемы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] графики, таблицы, схемы |
| - | [[Image:1236084776 kr.jpg|10x10px]] юмор, анекдоты, приколы, комиксы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] юмор, анекдоты, приколы, комиксы |
| - | [[Image:1236084776 kr.jpg|10x10px]] притчи, поговорки, кроссворды, цитаты | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] притчи, поговорки, кроссворды, цитаты |
| | | | |
| | '''<u>Дополнения</u>''' | | '''<u>Дополнения</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] рефераты''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рефераты''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] статьи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статьи |
| - | [[Image:1236084776 kr.jpg|10x10px]] фишки для любознательных | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фишки для любознательных |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] учебники основные и дополнительные | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] учебники основные и дополнительные |
| - | [[Image:1236084776 kr.jpg|10x10px]] словарь терминов | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словарь терминов |
| - | [[Image:1236084776 kr.jpg|10x10px]] прочие | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] прочие |
| | '''<u></u>''' | | '''<u></u>''' |
| | <u>Совершенствование учебников и уроков | | <u>Совершенствование учебников и уроков |
| - | </u>'''[[Image:1236084776 kr.jpg|10x10px]] исправление ошибок в учебнике''' | + | </u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] исправление ошибок в учебнике''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] обновление фрагмента в учебнике | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обновление фрагмента в учебнике |
| - | [[Image:1236084776 kr.jpg|10x10px]] элементы новаторства на уроке | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] элементы новаторства на уроке |
| - | [[Image:1236084776 kr.jpg|10x10px]] замена устаревших знаний новыми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] замена устаревших знаний новыми |
| - |
| + | |
| | '''<u>Только для учителей</u>''' | | '''<u>Только для учителей</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] идеальные уроки ''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] идеальные уроки ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарный план на год | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарный план на год |
| - | [[Image:1236084776 kr.jpg|10x10px]] методические рекомендации | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методические рекомендации |
| - | [[Image:1236084776 kr.jpg|10x10px]] программы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] программы |
| - | [[Image:1236084776 kr.jpg|10x10px]] обсуждения | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обсуждения |
| | | | |
| | | | |
Версия 11:04, 2 июля 2012
Гипермаркет знаний>>Химия>>Химия 10 класс>> Химия: Ароматические углеводороды
Строение
Важнейшее ароматическое соединение — бензол.
Предметом нашего рассмотрения будут бензол и его гомологи — продукты замещения одного или более атомов водорода в молекуле бензола на углеводородные остатки.
Первое ароматическое соединение — бензол — открыто в 1825 г. Фарадеем. Была установлена его молекулярная формула — С6Н6. Если сравнить его состав с составом предельного углеводорода, содержащего такое же количество атомов углерода, — гексаном (С6Н14), то можно заметить, что бензол содержит на восемь атомов водорода меньше. Как известно, к уменьшению количества атомов водорода в молекуле. Модель углеводорода приводит появление кратных молекулы бензола связей и циклов. В 1865 г. Кекуле предложил его структурную формулу как циклогексатриена-1,3,5.
бензол циклогексатриен-1,3,5.
Как вы видите, молекула, соответствующая формуле Кекуле, содержит двойные связи, следовательно, бензол должен иметь ненасыщенный характер, т. е. легко вступать в реакции присоединения: гидрирования, бромирования, гидратации и т. д.
Однако данные многочисленных экспериментов показали, что бензол вступает в реакции присоединения только в жестких условиях (при высоких температурах и освещении), устойчив к окислению. Наиболее характерными для него являются реакции замещения, следовательно, бензол по характеру ближе к предельным углеводородам.
Пытаясь объяснить эти несоответствия, многие ученые предлагали различные варианты структуры бензола.
В настоящее время бензол обозначают или формулой Кекуле, или шестиугольником, в котором изображают окружность:
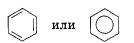
Так в чем же состоит особенность структуры бензола? На основании данных исследований и расчетов сделан вывод о том, что все шесть углеродных атомов находятся в состоянии sр2-гибридизации и лежат в одной плоскости. Негибридизованные р-орбитали атомов углерода, составляющие двойные связи (формула Кекуле), перпендикулярны плоскости кольца и параллельны друг другу.
Они перекрываются между собой, образуя единую тс-систему. Таким образом, система чередующихся двойных связей, изображенных в формуле Кекуле, является циклической системой сопряженных, перекрывающихся между собой п-связей.
Эта система представляет собой две тороидальные (похожие на бублик) области электронной плотности, лежащие по обе стороны бензольного кольца. Из всего сказанного можно сделать вывод, что изображать бензол в виде правильного шестиугольника с окружностью в центре (g-система) более логично, чем в виде циклогексатриена-1,3,5.
Американский ученый Л. Полинг предложил представлять бензол в виде двух граничных структур, отличающихся распределением электронной плотности и постоянно переходящих друг в друга, т. е. считать его промежуточным соединением, «усреднением» двух структур.
Данные измерения длин связей подтверждают эти предположения. Выяснено, что все С—С связи в бензоле имеют одинаковую длину (0,139 нм). Они несколько короче одинарных С—С связей (0,154 нм) и длиннее двойных (0,132 нм). Существуют также соединения, молекулы которых содержат несколько циклических структур.
Изомерия и номенклатура
Для гомологов бензола характерна изомерия положения нескольких заместителей. Простейший гомолог бензола — толуол (метил-бензол) не имеет таких изомеров, следующий гомолог представлен в виде четырех изомеров:
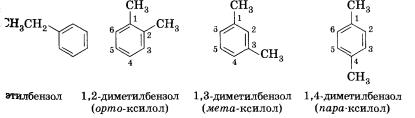
Основой названия ароматического углеводорода с небольшими заместителями является слово бензол. Атомы в ароматическом кольце нумеруют, начиная от старшего заместителя к младшему:
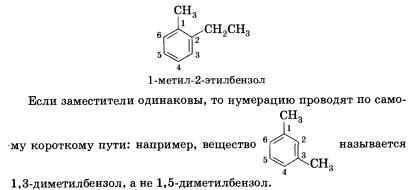
По старой, но до сих пор часто используемой номенклатуре положения 2 и 6 называют орто-положениями, 4 — пара-, а 3 и 5 — жета-положениями.
Физические свойства
Бензол и его простейшие гомологи в обычных условиях весьма токсичные жидкости с характерным неприятным запахом. Они плохо растворяются в воде, но хорошо — в органических растворителях.
Способы получения
Основным источником промышленного получения бензола и его гомологов является нефть и каменноугольная смола — один из продуктов сухой перегонки (коксования) каменного угля.
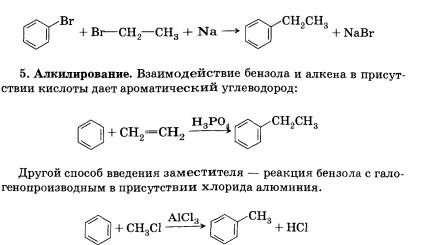
Среди синтетических способов получения аренов можно выделить две группы: получение собственно ароматического кольца и введение в кольцо углеводородного заместителя.
Для получения бензола и его гомологов можно использовать следующие реакции:
1. Дегидрирование циклогексана
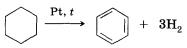
2. Ароматизация (дегидроциклизация) алканов. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:
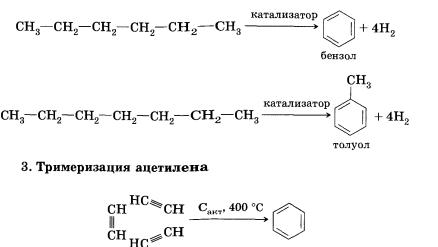
Ввести углеводородный заместитель в ароматическое кольцо (провести алкилирование) можно несколькими способами.
4. Синтез Вюрца. Это модификация уже известного нам способа получения алканов:
Химические свойства
Реакции замещения
Ароматические углеводороды вступают в реакции замещения.
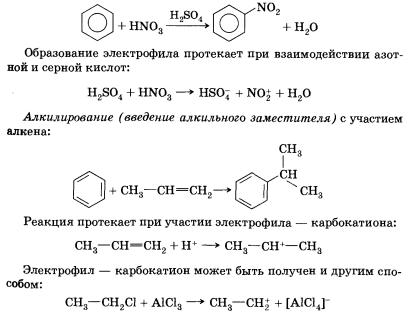
1. Бромирование. При реакции с бромом в присутствии катализатора, бромида железа(ІІІ), один из атомов водорода в бензольном кольце может замещаться на атом брома:
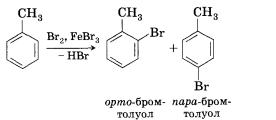
2. Нитрирование. Большое промышленное значение ва и его гомологов. При взаимодействии ароматического углеводорода с азотной кислотой в присутствии серной (смесь серной и азотной кислот называют нитрующей смесью) происходит замещение атома водорода на нитрогруппу —NO2.
Восстановлением образовавшегося в этой реакции нитробензола получают анилин — вещество, которое применяется для получения анилиновых красителей. Эта реакция носит имя замечательного русского химика Зинина.
Реакции присоединения
Ароматические соединения могут вступать и в реакции присоединения к бензольному кольцу. При этом образуются циклогексан или его производные.
1. Гидрирование. Каталитическое гидрирование бензола протекает при более высокой температуре, чем гидрирование алкенов.
2. Хлорирование. Реакция идет при освещении ультрафиолетовым светом и является свободнорадикальной.
Электрофильное замещение
Реакции замещения (бромирования и нитрования), упомянутые выше, протекают под воздействием электрофильных частиц, т. е. являются реакциями электрофильного замещения. Интересно, что они только формально (по конечному результату) относятся к реакциям замещения, а на самом деле это последовательность реакций присоединения и отщепления.
Механизм реакции электрофильного замещения.
Ароматическая структура бензола и подобных ему соединений обладает повышенной устойчивостью, и нарушение ее энергетически невыгодно. Это оказывает влияние на химические свойства ароматических соединений.
Наличие п-системы, области повышенной электронной плотности, делает структуру бензола выгодной для воздействия элек-трофилов, но, в отличие от непредельных соединений, эти реакции протекают не как присоединение, а как замещение.
Сравним механизмы реакций бромирования этена и бензола:
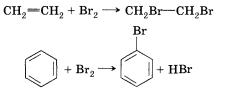
Присоединение брома к этену начинается с электрофильной атаки, которую мы формально, для упрощения рассуждений, представим как взаимодействие электронов п-связи с катионом брома.
Электрофильная частица, катион брома, образуется при гетеро-литическом расщеплении связи Вr—Вr, в результате которого появляется два иона:
Вr2 —> Вг+ + Вг-
Катион брома взаимодействует с молекулой этена и образует п-комплекс. При взаимодействии катиона брома с л-системой ароматического кольца также образуется п-комплекс, который отличается от соответствующей структуры, образованной этеном, тем, что незанятая орбиталь Вг+ в случае реакции с ароматическим соединением перекрывается с несколькими р-орбиталями, п-системой в целом.
Следующей переходной частицей после л-комплекса, образованного этеном и катионом брома, является карбокатион:
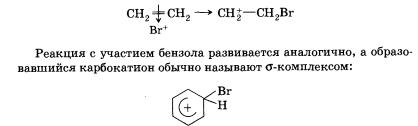
Обратите внимание, что образование этого комплекса приводит к переходу одного из атомов углерода в sр3-гибридизацию, нарушению циклической п-системы (ароматичности), снижению устойчивости соединения.
По этой причине, в отличие от реакции бромирования алкена, которая заканчивается присоединением аниона брома к карбока-тиону и образованию 1,2-дибромэтана.
Þ-комплекс стабилизируется в результате отщепления протона, и происходит восстановление ароматичности:
Таким образом, мы показали, что невыгодность нарушения ароматичности, которое происходит при нарушении цикличности Þ-системы, приводит к затруднению реакций присоединения к ароматическим системам и большей вероятности реакций замещения.
Þ-Система бензольного кольца является менее реакционноспособной структурой, чем Þ-связь в алкенах, поэтому для успешного протекания реакций необходимо применение катализаторов.
Катализатором описанной выше реакции является бромид железа(III), который, присоединяясь к молекуле брома, способствует образованию частицы Вг+ — активного электрофила. По электрофильному механизму идут многие реакции, в которых принимает участие бензол и другие ароматические соединения.
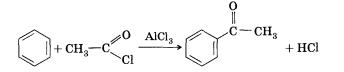
Нитрование
В данном случае карбокатион образуется при отщеплении хлора от хлорэтана под воздействием катализатора — АlСl3. Ацилирование (введение ацильной группы)
Ориентирующее действие заместителей
В молекуле бензола все атомы углерода эквивалентны. Элек-трофил может с равной вероятностью заместить катион водорода при любом из них. Но в случае наличия хотя бы одного заместителя реакция становится неоднозначной.
Влияние заместителей при бензольном кольце на направление реакции электрофильного замещения называют ориентирующим действием заместителей.
Можно однозначно сформулировать правило:
• донорные, подающие электронную плотность заместители направляют реакции электрофильного замещения во 2, 4, 6 (орто-, пара-) положения, как правило, повышают скорость реакции и называются заместителями (ориентантами) первого (I) рода;
• акцепторные, принимающие электронную плотность заместители направляют реакции электрофильного замещения в 3, 5 (мета-) положения, снижают скорость реакции и называются заместителями второго рода.
Для того чтобы объяснить это, надо рассмотреть устойчивость промежуточной частицы — Þ-комплекса, который образуется на одной из стадий реакции. Электрофил может присоединиться к разным атомам углерода. При этом образуется три варианта частиц:
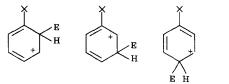
Наиболее устойчивый Þ-комплекс и определит направление реакции.
Для оценки устойчивости переходного состояния воспользуемся теорией резонанса. По этой теории каждая переходная частица будет описываться набором граничных (канонических) структур, образующихся при «перетекании» электронной плотности по системе сопряженных кратных связей:
Атака по атомам 2 и 6 (орто-положения)
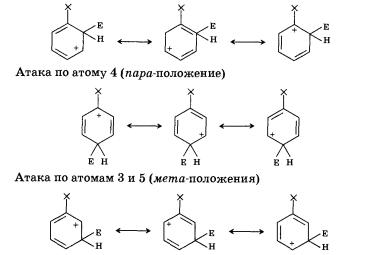
Видно, что при направлении атаки электрофила в сторону атомов 2, 4 и 6 образуется Þ-комплекс, причем одна из граничных структур содержит положительный заряд на атоме углерода, при котором находится заместитель. Если заместитель донорный, обладает положительным индуктивным или мезомерным эффектом, то именно эти структуры будут стабилизированы за счет частичной скомпенсированности положительного заряда.
Наличие акцепторного, обладающего отрицательным индуктивным или мезомерным эффектом заместителя приведет к уменьшению стабильности таких граничных структур и Þ-комплекса в целом.
В случае атаки по направлению атомов 3 и 5 не образуется ни одной структуры с положительным зарядом на атоме углерода при заместителе. В связи с этим наличие акцепторного заместителя не приведет к существенному снижению устойчивости переходного состояния именно в этом случае.
Характер электронных эффектов групп атомов мы обсуждали в § 9. Одним из заместителей с положительным индуктивным эффектом мы назвали метильную группу —СН3. Эта группа является ориентантом первого рода. Поэтому метилбензол (толуол) будет нитроваться в положения 2, 4, 6.
Образовавшееся соединение 2,4,6-тринитротолуол (тол, тротил) применяется как взрывчатое вещество.
В те же положения будет происходить бромирование гидрокси-бензола (фенола). Гидроксильная группа является ориентантом первого рода, так как обладает неподеленной парой электронов и проявляется +М-эффект.
Стабилизация промежуточной частицы, Þ-комплекса, происходит за счет перекрывания орбитали кислорода, на которой находится неподеленная пара электронов, и незаполненной орбитали углерода. При этом происходит образование дополнительной связи по донорно-акцепторному механизму. Таким образом, неподеленная электронная пара кислорода гид-роксильной группы и сопрягается с Þ-системой бензольного кольца (р — п-сопряжение).
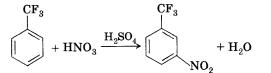
Акцепторная, обладающая -І-эффектом группа—СР3 в молекуле трифторметилбензола направляет реакции электрофильного замещения в 3 или 5 положение
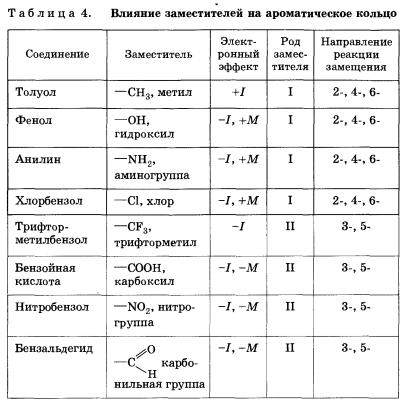
Заместители, обладающие различными ориентирующими свойствами, представлены в таблице 4.
Реакции по алкильному заместителю
Рассмотрим эти реакции на примере гомолога бензола — толуола.
Как уже было показано выше, метильная группа проявляет положительный индуктивный эффект по отношению к бензольному кольцу. Соответственно бензольное кольцо обладает отрицательным индуктивным эффектом по отношению к метильной группе. В результате этого она становится значительно более активной по сравнению с метильной группой в алифатических соединениях. Ал-кильные производные бензола гораздо охотнее и при более мягких условиях вступают в реакции свободнорадикального замещения (например, хлорирования) на свету, причем замещается водород в основном при атоме, который непосредственно присоединен к бензольному кольцу:
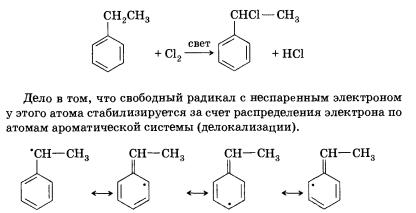
Кроме того, толуол можно окислить водным раствором перман-ганата калия, подкисленного серной кислотой, с образованием бензойной кислоты. Подобная реакция совершенно нехарактерна для алканов.
Применение бензола и его гомологов
Бензол применяется как растворитель и сырье для получения многочисленных и очень важных ароматических соединений, которые используются для производства красителей (анилин), полимеров (стирол, фенол, анилин), лекарственных препаратов (схема 6). Нитрованием толуола получают 2,4,6-тринитротолуол (тол, тротил) — мощное взрывчатое вещество.
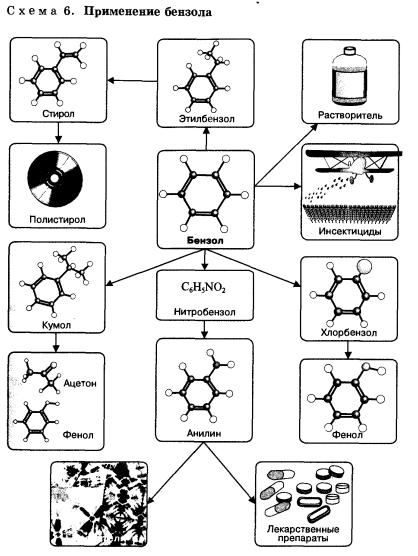
Окисление толуола, как уже было показано выше, дает бензойную кислоту, которая также является полупродуктом для получения многих важных органических соединений, применяется как сильный консервант (именно благодаря наличию большого количества бензойной кислоты долго не портятся некоторые ягоды — брусника, клюква).
Продукт окисления 1,4-диметилбензола (пара-ксилола) — терефталевая кислота применяется для получения полимерного материала — полиэфирного волокна лавсана.
1. Напишите формулы возможных изомеров углеводорода состава С9Н12, относящегося к ароматическому ряду.
2. Какие ароматические углеводороды могут образоваться при дегидроциклизации к-октана?
3. При хлорировании толуола в присутствии хлорида железа(III) получено два соединения с молекулярной формулой С7Н7Сl. Хлорирование толуола на свету приводит также к соединению с молекулярной формулой С7Н7Сl. Что это за соединения? Напишите уравнения соответствующих реакций.
4. Соединение А состава С7Н8 нитруется азотной кислотой в присутствии серной кислоты с образованием смеси соединений Б и В, имеющих общую формулу С7Н7N02. Окисление соединения А перманганатом калия в кислой среде приводит к соединению Г формулы С7Н602. Назовите соединения А, Б, В и Г, напишите уравнения соответствующих реакций.
5. Сколько граммов бензола прореагировало с бромом в присутствии бромида железа(Ш), если выделилось 224 мл бромистого водорода (н. у.)?
6. Сколько литров водорода (н. у.) могут присоединить в присутствии катализатора 100 г смеси, состоящей из 25% бензола, 15% толуола, 25% гексена и 35% гексана?
7. При нитровании 15,6 г бензола смесью концентрированных азотной и серной кислот выход мононитропро-изводного составил 70%. Сколько граммов продукта получено?
8*. Углеводород состава С9Н8 обесцвечивает бромную воду, при окислении образует бензойную кислоту, с аммиачным раствором оксида серебра дает осадок. Установите строение углеводорода, приведите уравнения соответствующих реакций.
9*. Напишите уравнения реакций, с помощью которых можно получить стирол, используя только неорганические соединения.
интерактивные технологии для урока химии, словарь терминов по химии, помощь ученикам в подготовке домашнего задания
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|

























