|
|
|
| Строка 1: |
Строка 1: |
| | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 10 класс|Химия 10 класс]]>> Химия: Валентные возможности атомов химических элементов<metakeywords>химия, 10 класс, класс, урок химии, на тему, урок на тему, урок для 10 класса, Валентные возможности атомов химических элементов</metakeywords>''' | | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 10 класс|Химия 10 класс]]>> Химия: Валентные возможности атомов химических элементов<metakeywords>химия, 10 класс, класс, урок химии, на тему, урок на тему, урок для 10 класса, Валентные возможности атомов химических элементов</metakeywords>''' |
| | | | |
| - | Строение наружных энергетических уровней атомов химических элементов и определяет в основном свойства их атомов. Поэтому эти уровни называют валентными. Электроны этих уровней, а иногда и предвнешних уровней могут принимать участие в образовании химических связей. Такие электроны также называют валентными.<br><br>Валентность атома химического элемента определяется в первую очередь числом неспаренных электронов, принимающих участие в образовании химической связи.<br><br>Валентные электроны атомов элементов главных подгрупп расположены на s- и р-орбиталях внешнего электронного слоя. У элементов побочных подгрупп, кроме лантаноидов и актиноидов, валентные электроны расположены на s-орбитали внешнего и d-орбиталях предвнешнего слоев.<br><br>Для того чтобы верно оценить валентные возможности атомов химических элементов, нужно рассмотреть распределение электронов в них по энергетическим уровням и подуровням и определить число неспаренных электронов в соответствии с принципом Паули и правилом Хунда для невозбужденного (основного, или стационарного) состояния атома и для возбужденного (то есть получившего дополнительную энергию, в результате чего происходит распаривание электронов внешнего слоя и переход их на свободные орбитали). Атом в возбужденном состоянии обозначают соответствующим символом элемента со звездочкой. Например, рассмотрим валентные возможности атомов фосфора в стационарном и возбужденном состояниях:<br>[[Image:11himR-11.jpg]]<br> | + | Строение наружных энергетических уровней атомов химических элементов и определяет в основном свойства их атомов. Поэтому эти уровни называют валентными. Электроны этих уровней, а иногда и предвнешних уровней могут принимать участие в образовании [[Химическая_связь|химических связей]]. Такие электроны также называют валентными.<br><br>Валентность атома химического элемента определяется в первую очередь числом неспаренных электронов, принимающих участие в образовании химической связи.<br><br>[[Валентные_состояния_атома_углерода|Валентные электроны]] атомов элементов главных подгрупп расположены на s- и р-орбиталях внешнего электронного слоя. У элементов побочных подгрупп, кроме лантаноидов и актиноидов, валентные электроны расположены на s-орбитали внешнего и d-орбиталях предвнешнего слоев.<br><br>Для того чтобы верно оценить валентные возможности атомов химических элементов, нужно рассмотреть распределение электронов в них по энергетическим уровням и подуровням и определить число неспаренных электронов в соответствии с принципом Паули и правилом Хунда для невозбужденного (основного, или стационарного) состояния атома и для возбужденного (то есть получившего дополнительную энергию, в результате чего происходит распаривание электронов внешнего слоя и переход их на свободные орбитали). Атом в возбужденном состоянии обозначают соответствующим символом элемента со звездочкой. Например, рассмотрим валентные возможности атомов фосфора в стационарном и возбужденном состояниях:<br>[[Image:11himR-11.jpg|Валентные возможности атомов химических элементов]]<br> |
| | | | |
| | + | <br> |
| | | | |
| | + | В невозбужденном состоянии атом фосфора имеет три не-спаренных электрона на р-подуровне. При переходе атома в возбужденное состояние один из пары электронов d-подуровня может переходить на свободную орбиталь d-подуровня. Валентность фосфора при этом изменяется с трех (в основном состоянии) до пяти (в возбужденном состоянии).<br><br>Разъединение спаренных электронов требует затрат энергии, так как спаривание электронов сопровождается понижением потенциальной энергии атомов. Вместе с тем расход энергии на перевод атома в возбужденное состояние компенсируется энергией, выделяющейся при образовании химических связей неспаренными электронами.<br><br>Так, атом [[Углерод_(Химия_9_класс)|углерода]] в стационарном состоянии имеет два неспаренных электрона. Следовательно, с их участием могут образоваться две общие электронные пары, осуществляющие две ковалентные связи. Однако вам хорошо известно, что во многих неорганических и во всех органических соединениях присутствуют атомы четырехвалентного углерода. Очевидно, что его атомы образовали четыре ковалентные связи в этих соединениях, находясь в возбужденном состоянии.<br>[[Image:11himR-12.jpg|Валентные возможности атомов химических элементов]] |
| | | | |
| - | В невозбужденном состоянии атом фосфора имеет три не-спаренных электрона на р-подуровне. При переходе атома в возбужденное состояние один из пары электронов d-подуровня может переходить на свободную орбиталь d-подуровня. Валентность фосфора при этом изменяется с трех (в основном состоянии) до пяти (в возбужденном состоянии).<br><br>Разъединение спаренных электронов требует затрат энергии, так как спаривание электронов сопровождается понижением потенциальной энергии атомов. Вместе с тем расход энергии на перевод атома в возбужденное состояние компенсируется энергией, выделяющейся при образовании химических связей неспаренными электронами.<br><br>Так, атом углерода в стационарном состоянии имеет два неспаренных электрона. Следовательно, с их участием могут образоваться две общие электронные пары, осуществляющие две ковалентные связи. Однако вам хорошо известно, что во многих неорганических и во всех органических соединениях присутствуют атомы четырехвалентного углерода. Очевидно, что его атомы образовали четыре ковалентные связи в этих соединениях, находясь в возбужденном состоянии.<br>[[Image:11himR-12.jpg]]
| + | <br> |
| | | | |
| | + | Затраты энергии на возбуждение атомов углерода с избытком компенсируются энергией, выделяющейся при образовании двух дополнительных ковалентных связей. Так, для перевода атомов углерода из стационарного состояния 2s<sup>2</sup>2р<sup>2</sup> в возбужденное — 2s<sup>1</sup>2р<sup>3</sup> требуется затратить около 400 кДж/моль энергии. Но при образовании С—Н-связи в предельных углеводородах выделяется 360 кДж/моль. Следовательно, при образовании двух молей С—Н-связей выделится 720 кДж, что превышает энергию перевода атомов углерода в возбужденное состояние на 320 кДж/моль.<br><br>В заключение следует отметить, что валентные возможности атомов химических элементов далеко не исчерпываются числом неспаренных электронов в стационарном и возбужденном состояниях атомов. Если вы вспомните донорно-ак-цепторный механизм образования ковалентных связей, то вам станут понятны и две другие валентные возможности атомов химических элементов, которые определяются наличием свободных орбиталей и наличием неподеленных электронных пар, способных дать [[Ковалентная_полярная_химическая_связь._Полные_уроки|ковалентную химическую связь]] по донор-но-акцепторному механизму. Вспомните образование иона аммония NH4+. (Более подробно мы рассмотрим реализацию этих валентных возможностей атомами химических элементов при изучении химической связи.)<br><br>Сделаем общий вывод.<br><br>Валентные возможности атомов химических элементов определяются: 1) числом неспаренных электронов (одноэлектронных орбиталей); 2) наличием свободных орбиталей; 3) наличием неподеленных пар электронов. |
| | | | |
| | + | <br>1. Какими тремя факторами определяются валентные возможности атомов химических элементов?<br>2. Почему максимальная валентность атомов элементов второго периода не может быть больше четырех?<br>3. Вспомните, чем отличаются понятия валентности и степени окисления. Что между ними общего?<br>4. Укажите валентность и степень окисления атомов [[Азот_(Химия_9_класс)|азота]] в ионе аммония NH4+.<br>5. Определите валентность и степень окисления атомов углерода в веществах с формулами С2Н6, С2Н4, С2Н2.<br>6. Определите валентность и степень окисления атомов в веществах с формулами N2, NF3, Н202, ОF2, 02F2.<br>7. Определите валентные возможности атомов серы и хлора в основном и возбужденном состояниях.<br> |
| | | | |
| - | Затраты энергии на возбуждение атомов углерода с избытком компенсируются энергией, выделяющейся при образовании двух дополнительных ковалентных связей. Так, для перевода атомов углерода из стационарного состояния 2s<sup>2</sup>2р<sup>2</sup> в возбужденное — 2s<sup>1</sup>2р<sup>3</sup> требуется затратить около 400 кДж/моль энергии. Но при образовании С—Н-связи в предельных углеводородах выделяется 360 кДж/моль. Следовательно, при образовании двух молей С—Н-связей выделится 720 кДж, что превышает энергию перевода атомов углерода в возбужденное состояние на 320 кДж/моль.<br><br>В заключение следует отметить, что валентные возможности атомов химических элементов далеко не исчерпываются числом неспаренных электронов в стационарном и возбужденном состояниях атомов. Если вы вспомните донорно-ак-цепторный механизм образования ковалентных связей, то вам станут понятны и две другие валентные возможности атомов химических элементов, которые определяются наличием свободных орбиталей и наличием неподеленных электронных пар, способных дать ковалентную химическую связь по донор-но-акцепторному механизму. Вспомните образование иона аммония NH4+. (Более подробно мы рассмотрим реализацию этих валентных возможностей атомами химических элементов при изучении химической связи.)<br><br>Сделаем общий вывод.<br><br>Валентные возможности атомов химических элементов определяются: 1) числом неспаренных электронов (одноэлектронных орбиталей); 2) наличием свободных орбиталей; 3) наличием неподеленных пар электронов.
| + | <br> <sub>акселеративные методы по [[Химия 11 класс|химии 11 класса]], дискуссионные вопросы [[Химия|по химии]], приколы и анекдоты [[Гипермаркет знаний - первый в мире!|к урокам]]</sub> |
| - | | + | |
| - | <br>1. Какими тремя факторами определяются валентные возможности атомов химических элементов?<br>2. Почему максимальная валентность атомов элементов второго периода не может быть больше четырех?<br>3. Вспомните, чем отличаются понятия валентности и степени окисления. Что между ними общего?<br>4. Укажите валентность и степень окисления атомов азота в ионе аммония NH4+.<br>5. Определите валентность и степень окисления атомов углерода в веществах с формулами С2Н6, С2Н4, С2Н2.<br>6. Определите валентность и степень окисления атомов в веществах с формулами N2, NF3, Н202, ОF2, 02F2.<br>7. Определите валентные возможности атомов серы и хлора в основном и возбужденном состояниях.<br>
| + | |
| - | | + | |
| - | <br> <sub>акселеративные методы по [[Химия_11_класс|химии 11 класса]], дискуссионные вопросы [[Химия|по химии]], приколы и анекдоты [[Гипермаркет_знаний_-_первый_в_мире!|к урокам]]</sub> | + | |
| | | | |
| | '''<u>Содержание урока</u>''' | | '''<u>Содержание урока</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] конспект урока ''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект урока ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] опорный каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] опорный каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентация урока | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентация урока |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративные методы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративные методы |
| - | [[Image:1236084776 kr.jpg|10x10px]] интерактивные технологии | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] интерактивные технологии |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачи и упражнения | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачи и упражнения |
| - | [[Image:1236084776 kr.jpg|10x10px]] самопроверка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] самопроверка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикумы, тренинги, кейсы, квесты | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикумы, тренинги, кейсы, квесты |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашние задания | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашние задания |
| - | [[Image:1236084776 kr.jpg|10x10px]] дискуссионные вопросы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] дискуссионные вопросы |
| - | [[Image:1236084776 kr.jpg|10x10px]] риторические вопросы от учеников | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] риторические вопросы от учеников |
| - |
| + | |
| | '''<u>Иллюстрации</u>''' | | '''<u>Иллюстрации</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] аудио-, видеоклипы и мультимедиа ''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] аудио-, видеоклипы и мультимедиа ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] фотографии, картинки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фотографии, картинки |
| - | [[Image:1236084776 kr.jpg|10x10px]] графики, таблицы, схемы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] графики, таблицы, схемы |
| - | [[Image:1236084776 kr.jpg|10x10px]] юмор, анекдоты, приколы, комиксы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] юмор, анекдоты, приколы, комиксы |
| - | [[Image:1236084776 kr.jpg|10x10px]] притчи, поговорки, кроссворды, цитаты | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] притчи, поговорки, кроссворды, цитаты |
| | | | |
| | '''<u>Дополнения</u>''' | | '''<u>Дополнения</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] рефераты''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рефераты''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] статьи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статьи |
| - | [[Image:1236084776 kr.jpg|10x10px]] фишки для любознательных | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фишки для любознательных |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] учебники основные и дополнительные | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] учебники основные и дополнительные |
| - | [[Image:1236084776 kr.jpg|10x10px]] словарь терминов | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словарь терминов |
| - | [[Image:1236084776 kr.jpg|10x10px]] прочие | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] прочие |
| | '''<u></u>''' | | '''<u></u>''' |
| | <u>Совершенствование учебников и уроков | | <u>Совершенствование учебников и уроков |
| - | </u>'''[[Image:1236084776 kr.jpg|10x10px]] исправление ошибок в учебнике''' | + | </u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] исправление ошибок в учебнике''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] обновление фрагмента в учебнике | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обновление фрагмента в учебнике |
| - | [[Image:1236084776 kr.jpg|10x10px]] элементы новаторства на уроке | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] элементы новаторства на уроке |
| - | [[Image:1236084776 kr.jpg|10x10px]] замена устаревших знаний новыми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] замена устаревших знаний новыми |
| - |
| + | |
| | '''<u>Только для учителей</u>''' | | '''<u>Только для учителей</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] идеальные уроки ''' | + | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] идеальные уроки ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарный план на год | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарный план на год |
| - | [[Image:1236084776 kr.jpg|10x10px]] методические рекомендации | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методические рекомендации |
| - | [[Image:1236084776 kr.jpg|10x10px]] программы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] программы |
| - | [[Image:1236084776 kr.jpg|10x10px]] обсуждения | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обсуждения |
| | | | |
| | | | |
Текущая версия на 14:50, 2 июля 2012
Гипермаркет знаний>>Химия>>Химия 10 класс>> Химия: Валентные возможности атомов химических элементов
Строение наружных энергетических уровней атомов химических элементов и определяет в основном свойства их атомов. Поэтому эти уровни называют валентными. Электроны этих уровней, а иногда и предвнешних уровней могут принимать участие в образовании химических связей. Такие электроны также называют валентными.
Валентность атома химического элемента определяется в первую очередь числом неспаренных электронов, принимающих участие в образовании химической связи.
Валентные электроны атомов элементов главных подгрупп расположены на s- и р-орбиталях внешнего электронного слоя. У элементов побочных подгрупп, кроме лантаноидов и актиноидов, валентные электроны расположены на s-орбитали внешнего и d-орбиталях предвнешнего слоев.
Для того чтобы верно оценить валентные возможности атомов химических элементов, нужно рассмотреть распределение электронов в них по энергетическим уровням и подуровням и определить число неспаренных электронов в соответствии с принципом Паули и правилом Хунда для невозбужденного (основного, или стационарного) состояния атома и для возбужденного (то есть получившего дополнительную энергию, в результате чего происходит распаривание электронов внешнего слоя и переход их на свободные орбитали). Атом в возбужденном состоянии обозначают соответствующим символом элемента со звездочкой. Например, рассмотрим валентные возможности атомов фосфора в стационарном и возбужденном состояниях:
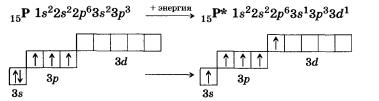
В невозбужденном состоянии атом фосфора имеет три не-спаренных электрона на р-подуровне. При переходе атома в возбужденное состояние один из пары электронов d-подуровня может переходить на свободную орбиталь d-подуровня. Валентность фосфора при этом изменяется с трех (в основном состоянии) до пяти (в возбужденном состоянии).
Разъединение спаренных электронов требует затрат энергии, так как спаривание электронов сопровождается понижением потенциальной энергии атомов. Вместе с тем расход энергии на перевод атома в возбужденное состояние компенсируется энергией, выделяющейся при образовании химических связей неспаренными электронами.
Так, атом углерода в стационарном состоянии имеет два неспаренных электрона. Следовательно, с их участием могут образоваться две общие электронные пары, осуществляющие две ковалентные связи. Однако вам хорошо известно, что во многих неорганических и во всех органических соединениях присутствуют атомы четырехвалентного углерода. Очевидно, что его атомы образовали четыре ковалентные связи в этих соединениях, находясь в возбужденном состоянии.
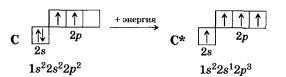
Затраты энергии на возбуждение атомов углерода с избытком компенсируются энергией, выделяющейся при образовании двух дополнительных ковалентных связей. Так, для перевода атомов углерода из стационарного состояния 2s22р2 в возбужденное — 2s12р3 требуется затратить около 400 кДж/моль энергии. Но при образовании С—Н-связи в предельных углеводородах выделяется 360 кДж/моль. Следовательно, при образовании двух молей С—Н-связей выделится 720 кДж, что превышает энергию перевода атомов углерода в возбужденное состояние на 320 кДж/моль.
В заключение следует отметить, что валентные возможности атомов химических элементов далеко не исчерпываются числом неспаренных электронов в стационарном и возбужденном состояниях атомов. Если вы вспомните донорно-ак-цепторный механизм образования ковалентных связей, то вам станут понятны и две другие валентные возможности атомов химических элементов, которые определяются наличием свободных орбиталей и наличием неподеленных электронных пар, способных дать ковалентную химическую связь по донор-но-акцепторному механизму. Вспомните образование иона аммония NH4+. (Более подробно мы рассмотрим реализацию этих валентных возможностей атомами химических элементов при изучении химической связи.)
Сделаем общий вывод.
Валентные возможности атомов химических элементов определяются: 1) числом неспаренных электронов (одноэлектронных орбиталей); 2) наличием свободных орбиталей; 3) наличием неподеленных пар электронов.
1. Какими тремя факторами определяются валентные возможности атомов химических элементов?
2. Почему максимальная валентность атомов элементов второго периода не может быть больше четырех?
3. Вспомните, чем отличаются понятия валентности и степени окисления. Что между ними общего?
4. Укажите валентность и степень окисления атомов азота в ионе аммония NH4+.
5. Определите валентность и степень окисления атомов углерода в веществах с формулами С2Н6, С2Н4, С2Н2.
6. Определите валентность и степень окисления атомов в веществах с формулами N2, NF3, Н202, ОF2, 02F2.
7. Определите валентные возможности атомов серы и хлора в основном и возбужденном состояниях.
акселеративные методы по химии 11 класса, дискуссионные вопросы по химии, приколы и анекдоты к урокам
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|












