|
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Кристаллические решетки
Вещество, как вам известно, может существовать в трех агрегатных состояниях: газообразном, жидком и твердом. Например, кислород, который при обычных условиях представляет собой газ, при температуре -194 °С превращается в жидкость голубого цвета, я при температуре -218,8º С затвердевает в снегообразную массу, состоящую из кристаллов синего цвета.
В этом параграфе мы рассмотрим, как влияют особенности химических связей на свойства твердых веществ. Температурный интервал существования вещества в твердом состоянии определяется его температурами кипения и плавления. Твердые вещества делятся на кристаллические и аморфные.
Аморфные вещества не имеют четкой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находится пластилин или различные смолы.
Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов. — в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, который называют кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют изложи решетки.
В узлах воображаемой решетки могут находиться ионы, атомы и молекулы. Эти частицы совершают колебательные движения. С повышением температуры размах этих колебаний возрастает, что приводит, как правило, к тепловому расширению тел.
В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические (табл. 6).
Простые вещества остальных элементов, не представленные в таблице 6, имеют металлическую решетку.
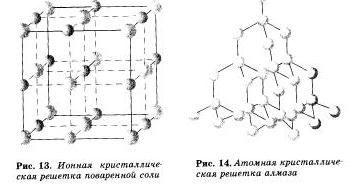
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+,Сl-, так и сложные SO 2- 4, ОН-. Следовательно, ионные кристаллические решетки имеют соли, некоторые оксиды и гидроксиды металлов, то есть те вещества, в которых существует ионная химическая связь. Например, кристалл хлорида натрия построен из чередующихся положительных ионов Na+ и отрицательных Сl-, образующих решетку в форме куба. Связи между ионами в таком кристалле очень устойчивы. Поэтому вещества с ионной решетной обладают сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Атомными наливают кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентними связями. Примером веществ с таким типом кристаллических решеток может служить алмаз — одно из аллотропных видоизменений углерода.

Число веществ с атомной кристаллической решеткой не очень велико. К ним относятся кристаллические бор, кремний и германий, а также сложные вещества, например такие, в состав которых входит оксид кремния (IV) — SlО2: кремнезем, кварц, песок, горный хрусталь.
Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (например, у алмаза она свыше 3500 ºС), они прочны и тверды, практически нерастворимы.
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и полярными и неполяриыми. Несмотря на то что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы можмолекулярно-го притяжения. Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи.
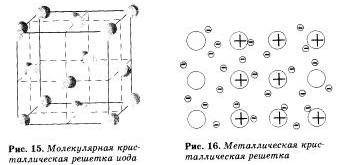
Примерами веществ с молекулярными кристаллическими решетками являются твердая вода - лед, твердый оксид углерода (IV) — «сухой лед», твердые хлороводород и сероводород, твердые простые вещества, образованные одно- (благородные газы), двух- , трех- (О3), четырех- (Р4). восьмиатомными молекулами. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
Вещества с металлической связью имеют металлические кристаллические решетки. В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны в общее пользование). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
Для веществ, имеющих молекулярное строение, справедлив открытый французским химиком Ж. Л. Прустом (1799—1803) закон постоянства состава. В настоящее время этот закон формулируется так: «Молекулярные химические соединения независимо от способа их получения имеют постоянный состав и свойства. Закон Пруста является одним из основных законов химии. Однако для веществ с нсмолекулярным строением, например ионным, этот закон не всегда справедлив.
1. Твердое, жидкое и газообразное состояния вещества.
2. Твердые вещества: аморфные и кристаллические.
3. Кристаллические решетки: атомные, ионные, металлические и молекулярные.
4. Закон постоянства состава.
Какие свойства нафталина лежат в основе его применения для защиты шерстяных изделий от моли?
Какие качества аморфных тел применимы для опнсаиия особенностей характера отдельных людей?
Почему открытый датским ученым К. X. Эрстедом алюминий в 1825 г. еще долгое время относился к драгоценным металлам?
Вспомните произведение А. Беляева «Продавец воздуха» и охарактеризуйте свойства твердого кислорода, используя его описание, приведенное в книге.
Почему температура плавления металлов изменяется в очень широких пределах? Для подготовки ответа на этот вопрос используйте дополнительную литературу.
Почему изделие из кремния при ударе раскалывается на кусочки, а изделие из свинца только расплющивается? В каком из указанных случаев происходит разрушение химической связи, а в каком — нет? Почему?
конспекты уроков 8 класса, аудио для урока химии, книги по всем предметам
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|













