Текущая версия на 14:04, 25 июня 2012Гипермаркет знаний>>Химия>>Химия 8 класс. Полные уроки>>Химия: Кристаллические решетки. Полные уроки Тема: Кристаллические решетки.
Цели урока
Задачи уроки
Основные термины
Аморфные вещества – это такие вещества, которые по своим свойствам они имеют место между жидкостями и кристаллами, поэтому из нельзя полностью отнести к твердым телам. Кристаллические вещества характеризуются имением кристаллической структуры. Кристаллы данной структуры могут быть разнообразными по форме (в наше время определяют 14 кристаллографических типов решеток). По типу взаимодействия между частицами могут быть ионные, атомные и молекулярные решетки. Кристаллическая решетка – это вспомогательный геометрический образ. Решетка имеет сходство со стекой или канвой, что дает причины называть точки решетки узлами. Решетка – это совокупность точек, которые рождаются из произвольной отдельно выбранной точки кристалла под воздействием группы трансляции.
Ход урока
Проверка домашнего задания.
Дайте короткий ответ на вопросы: 1. Какие виды частиц вам известны? 2. Имеют ли заряды, атомы, молекулы, ионы? 3. Какие виды химических связей вам известны? 4. Какие агрегатные состояния вещества вы знаете?
Аморфные вещества.
У аморфных веществ нет четкой температуре плавления – при нагревании они со временем размягчаются и переходят в текучее состояние. К аморфным веществам можно отнести, к примеру, шоколад, который тает во рту и в руках; пластилин, жевательную резинку, пластмассы, воск. На рисунках 1 и 2 вы сможете наблюдать несколько примеров аморфных веществ. Рис.1 Растопленный шоколад Рис.2 Пластилин Также к аморфным веществам относиться любимый многими десерт – желе. Давайте посмотрим познавательный ролик на эту тему:
Кристаллические вещества. Кристаллическая решетка.
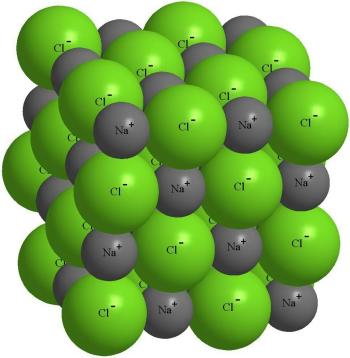
У кристаллических веществ есть четкая температура плавления, а главное, они характеризуются правильным расположением частиц в определенно строгих точках пространства. Во время соединения данных точек прямыми линиями рождается пространственный каркас, это собственно и есть кристаллическая решетка. Элементарная ячейка кристалла поваренной соли имеет форму куба, у которого в центре и углам каждой грани находятся ионы натрия. Ячейка данного типа называется гранецентрированной кубической. На рисунке 3 вы увидите кристаллическую решетку поваренной соли. Рис.3 Кристаллическая решетка поваренной соли Кристаллическая решетка алмаза, каждый атом которой углерода ковалентно связан с соседними четырьмя атомами, тоже характеризуется гранецентрированной кубической элементарной ячейкой. Алмаз – это очень твердое вещество, которое имеет достаточно высокую температуру перехода. Посмотрим на кристаллическую решетку на рисунке 4. Рис.4 Кристаллическая решетка алмаза Совсем по-иному располагаются атомы углерода в графите. Тут они образуют слои, которые не прочно связаны друг с другом. Каждый слой представлен шестиугольниками из углеродных атомов. Так как сцепление между слоями достаточно слабое, графит мягкий. Слои без проблем скользят один по отношению к другому, с помощью чего графит есть хорошим смазочным материалом. Давайте посмотрим на кристаллическую решетку графита на рисунке 5. Рис.5 Кристаллическая решетка графита Посмотрим видео, посвященное кристаллическим решеткам:
Выводы.
Становиться понятным, что именно от вида вещества, а затем от вида его кристаллических решеток. Твердые вещества бывают кристаллическими аморфными. У аморфными веществ молекулы находятся в случайном порядке. Наоборот, молекулы кристаллических веществ находятся строго упорядоченно.
Контролирующий блок.
1. Какие вещества называются аморфными? 2. Какие вещества называются кристаллическими? 3. Объясните понятие «кристаллическая решетка». 4. В каком агрегатном состоянии у веществ есть кристаллические решетки? 5. Какие типы кристаллических решеток вы знаете?
Домашнее задание.
Подготовить сообщения на темы: «Жидкие металлы. Их свойства». «Свойства алмаза. Его применение».
Интересно знать, что.
Состав керамического материала титана бария есть совокупностью, который составлен из микрокристаллов от одного до двадцати миллиметров в диаметре. Каждый их этих кристаллов называется частицей, которая в свою очередь разделена на большое количество доменов, температура которых ниже Точки Кюри. Посмотри подробнее об этом на видео механизм строения механического конденсатора:
Список литературы
1. Урок на тему «Кристаллические решётки» Руднева В. А., учитель химии, ЗОШ № 5, Воронеж; 2. Урок на тему «Типы химических веществ» Степанова М. Л., учитель химии, ЗОШ № 67, Москва; 3. Урок на тему «Виды кристаллических решеток» Генералова Т. Я., учитель химии, ЗОШ № 16, краснодарский край; 4. Карцова А.А. Химия без формул или Знакомые незнакомцы. М.,2005.
Отредактировано и выслано Борисенко И.Н.
Над уроком работали: Руднева В.А. Степанова М.Л. Генералова Т.Я. Борисенко И.Н. Поставить вопрос о современном образовании, выразить идею или решить назревшую проблему Вы можете на Образовательном форуме, где на международном уровне собирается образовательный совет свежей мысли и действия. Создав блог, Вы не только повысите свой статус, как компетентного преподавателя, а и сделаете весомый вклад в развитие школы будущего. Гильдия Лидеров Образования открывает двери для специалистов высшего ранга и приглашает к сотрудничеству в направлении создания лучших в мире школ. Предмети > Химия > Химия 8 класс |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: